Ketohexokinase
| Ketohexokinase | ||
|---|---|---|
| ||
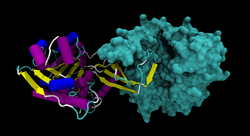
| Bänder-/Oberflächenmodell des KHK-Dimers mit Inhibitor als Stäbchen, nach PDB 3NBW | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 298 Aminosäuren | |
| Sekundär- bis Quartärstruktur | A+A, A+C, C+C | |
| Isoformen | A, C | |
| Bezeichner | ||
| Gen-Name | KHK | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.1.3, Kinase | |
| Reaktionsart | Phosphorylierung | |
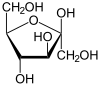
| Substrat | ATP + β-D-Fructose | |
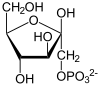
| Produkte | ADP + D-Fructose-1-phosphat | |
| Vorkommen | ||
| Homologie-Familie | Ketohexokinase | |
| Übergeordnetes Taxon | Euteleostomi | |
Ketohexokinase (KHK) (auch: Hepatische Fructokinase oder einfach Fructokinase, älter auch Fruktokinase) ist der Name des Enzyms, das Fructose phosphoryliert. Dies ist der erste Schritt in der Verwertung von Fructose durch Wirbeltiere. Im Menschen ist KHK überdurchschnittlich in Leber, Nieren, Darm, Milz und Pankreas lokalisiert. Mutationen im KHK-Gen können zur (seltenen) Fructosurie führen, der erblichen Unfähigkeit, Fructose zu verdauen – sie wird in diesem Fall über den Urin ausgeschieden.[1]
Es existieren zwei Isoformen der KHK, genannt A und C, die durch alternatives Spleißen entstehen. Isoform C ist hauptsächlich in der Leber lokalisiert. Aktive KHK ist ein Dimer, das sich aus einer oder beiden Isoformen zusammensetzt. Vermutlich liegt bei der Fructosurie nur ein Mangel an Isoform C vor.[2]
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]β-D-Fructose wird zu Fructose-1-phosphat phosphoryliert. Als weitere Substrate sind D-Sorbose, D-Agatose oder 5-Dehydrofructose möglich. Die Reaktion wird durch Anwesenheit von Kalium stimuliert und durch ADP gebremst.[1][3]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- reactome.org: ATP + beta-D-fructose ⇒ ADP + D-fructose 1-phosphate