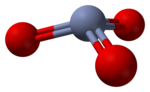
Kromium trioksida

| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Kromium trioksida
| |
| Nama lain
Krom anhidrat, Kromium(VI) oksida, Asam kromat (misnomer)
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 1463 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| CrO3 | |
| Massa molar | 99,99 g·mol−1 |
| Penampilan | Padatan granular merah gelap, higroskopis |
| Bau | Tak berbau |
| Densitas | 2.7 g/cm3 (20 °C)[1] |
| Titik lebur | 197 °C (387 °F; 470 K) [1] |
| Titik didih | 250 °C (482 °F; 523 K) terurai[1] |
| 164.8 g/100 mL (0 °C) 169 g/100 mL (25 °C)[1] 172.6 g/100 mL (40 °C) 198.1 g/100 mL (100 °C)[2] | |
| Kelarutan | Larut dalam H2SO4, HNO3, (C2H5)2O, CH3COOH, aseton |
| +40·10−6 cm3/mol[1] | |
| Termokimia | |
| Entropi molar standar (S |
73.2 J/mol·K[3] |
| Entalpi pembentukan standar (ΔfH |
−589.3 kJ/mol[4] |
| Bahaya | |
| Lembar data keselamatan | ICSC 1194 |
| Piktogram GHS |      [5] [5]
|
| Keterangan bahaya GHS | {{{value}}} |
| H271, H301, H311, H314, H317, H330, H334, H340, H350, H361, H372, H410[5] | |
| P201, P220, P260, P273, P280, P284[5] | |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
80 mg/kg (tikus, oral)[6] |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kromium trioksida adalah suatu senyawa anorganik dengan rumus kimia CrO3. Senyawa ini merupakan anhidrida asam dari asam kromat, dan terkadang dipasarkan dengan nama sejenis.[6] Senyawa ini adalah sebuah padatan berwarna merah gelap dalam kondisi anhidrat, berwarna jingga cerah saat basah dan larut dalam air bersamaan dengan hidrolisis. Jutaan kilogram senyawa ini diproduksi setiap tahun, terutama untuk galvanisasi.[7] Kromium trioksida adalah oksidator kuat dan dicurigai sebagai suatu karsinogen.
Produksi, struktur dan reaksi
[sunting | sunting sumber]Kromium trioksida dihasilkan dengan memperlakukan natrium kromat atau natrium dikromat yang sesuai dengan asam sulfat:[6]
- H2SO4 + Na2Cr2O7 → 2 CrO3 + Na2SO4 + H2O
Kira-kira 100M kg diproduksi setiap tahun oleh jalur reaksi ini atau yang serupa.[7]
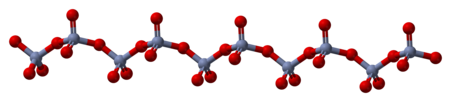
Padatan terdiri dari rantai atom kromium terkoordinasi secara tetrahedral yang memiliki simpul. Setiap pusat krom, oleh karenanya, berbagi dua pusat oksigen dengan tetangganya. Dua atom oksigen tidak dibagi, memberikan stoikiometri keseluruhan 1:3.[8][9]
Struktur monomer CrO3 telah dikalkulasi menggunakan teori fungsi rapatan (DFT), dan diprediksi piramidal (kelompok titik C3v) dan bukan planar (kelompok titik D3h).[10]
Kromium trioksida terurai di atas 197 °C melepaskan oksigen dan menghasilkan Cr2O3:
- 4 CrO3 → 2 Cr2O3 + 3 O2
Senyawa ini digunakan dalam sintesis organik sebagai oksidan, sering sebagai larutan dalam asam asetat,[8] atau aseton dalam kasus oksidasi Jones. Dalam oksidasi ini, Cr(VI) mengubah alkohol primer menjadi asam karboksilat yang sesuai dan alkohol sekunder menjadi keton. Reaksi ini dituliskan sebagai berikut:
- Alkohol primer
- 4 CrO3 + 3 RCH2OH + 12 H+ → 3 RCOOH + 4 Cr3+ + 9 H2O
- Alkohol sekunder
- 2 CrO3 + 3 R2CHOH + 6 H+ → 3 R2C=O + 2 Cr3+ + 6 H2O
Aplikasi
[sunting | sunting sumber]Kromium trioksida terutama digunakan dalam pelapisan krom. Hal ini biasanya digunakan dengan aditif yang mempengaruhi proses pelapisan tetapi tidak bereaksi dengan trioksida. Trioksida bereaksi dengan kadmium, seng, dan logam lainnya untuk menghasilkan film kromat pasif yang dapat menahan laju korosi. Senyawa ini juga digunakan dalam produksi rubi sintetik. Larutan asam kromat juga digunakan dalam penerapan pelapisan anodik kepada aluminium, yang terutama digunakan dalam aplikasi ruang angkasa. Larutan asam kromat/ asam fosfat juga merupakan pelarut pelapis anodik dari semua jenis.
Keamanan
[sunting | sunting sumber]Kromium trioksida sangat beracun, korosif, dan bersifat karsinogenik.[11] Senyawa ini merupakan contoh utama kromium heksavalensi, suatu kelompok zat kimia berbahaya bagi lingkungan. Turunan kromium(III) yang terkait tidak terlalu berbahaya; Dengan demikian, reduktor digunakan untuk menghancurkan sampel kromium(VI).
Kromium trioksida, sebagai oksidator kuat, akan menyulut bahan organik seperti alkohol ketika dalam kontak.
Galeri
[sunting | sunting sumber]-
Larutan kalium dikromat pekat dalam air.
-
Penambahan asam sulfat ke dalam larutan.
-
Kristalisasi kromium trioksida dari reaksi.
-
Reaksi antara kromium trioksida dan etanol
Referensi
[sunting | sunting sumber]- ^ a b c d e Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (edisi ke-90). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (edisi ke-2nd). D. Van Nostrand Company. hlm. 250.
- ^ chromium(VI) oxide
- ^ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. ISBN 0-07-049439-8.
- ^ a b c Sigma-Aldrich Co., Chromium(VI) oxide. Diakses tanggal 2014-06-15.
- ^ a b c d "Chromium trioxide". http://www.chemicalland21.com. AroKor Holdings Inc. Diakses tanggal 2014-06-15. Hapus pranala luar di parameter
|website=(bantuan) - ^ a b Anger, G.; Halstenberg, J.; Hochgeschwender, K.; Scherhag, C.; Korallus, U.; Knopf, H.; Schmidt, P.; Ohlinger, M. (2000). "Chromium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a07_067. ISBN 3527306730.
- ^ a b Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (edisi ke-6th), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Stephens, J. S.; Cruickshank, D. W. J. (1970). "The crystal structure of (CrO3)∞". Acta Crystallographica Section B. 26 (3): 222. doi:10.1107/S0567740870002182.
- ^ Zhai, H. J.; Li, S.; Dixon, D. A.; Wang, L. S. (2008). "Probing the Electronic and Structural Properties of Chromium Oxide Clusters (CrO3)n−and (CrO3)n(n= 1–5): Photoelectron Spectroscopy and Density Functional Calculations". Journal of the American Chemical Society. 130 (15): 5167. doi:10.1021/ja077984d.
- ^ "Chromium Trioxide (MSDS)". J. T. Baker. Diakses tanggal 2007-09-13.