Litium nitrida
| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
Litium nitrida | |
| Nama lain
Trilitium nitrida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| Nomor EC | |
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| Li3N | |
| Massa molar | 34,83 g/mol |
| Penampilan | padatan merah, ungu |
| Densitas | 1,270 g/cm3 |
| Titik lebur | 813 °C |
| bereaksi | |
| log P | 3,24 |
| Struktur | |
| lihat teks | |
| Bahaya | |
| Bahaya utama | bereaksi dengan air membebaskan amonia |
| Senyawa terkait | |
Anion lain
|
Litium oksida |
Kation lainnya
|
Natrium nitrida |
Senyawa terkait
|
Litium amida, Litium imida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Litium nitrida adalah senyawa dengan rumus Li. Senyawa ini merupakan satu-satunya nitrida logam alkali yang stabil. Padatannya berwarna merah atau ungu dan memiliki titik leleh tinggi.[1]
Preparasi dan penanganan
[sunting | sunting sumber]Litium nitrida dibuat melalui penggabungan langsung unsur nitrium dengan gas nitrogen:[2]
Alih-alih membakar logam litium dalam atmosfer nitrogen, larutan litium dalam logam natrium cair dapat diberi perlakuan dengan N2. Litium nitrida bereaksi hebat dengan air menghasilkan amonia:
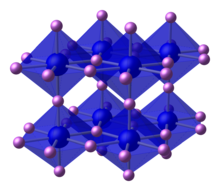
Struktur dan sifat
[sunting | sunting sumber]alfa-Li3N (stabil pada suhu dan tekanan ruang) memiliki struktur kristal yang tidak biasa yang terdiri dari dua jenis lapisan, satu lapisan memiliki komposisi Li2N− berisi pusat N 6-koordinasi dan lapisan lainnya hanya terdiri dari kation litium.[3] Dua bentuk lainnya yang diketahui: beta-Litium nitrida, yang terbentuk dari fase alfa pada 4.200 bar (4.100 atm) memiliki struktur natrium arsenida (Na3As); gamma-Litium nitrida (strukturnya sama seperti Li3Bi) terbentuk dari bentuk beta pada 35–45 gigapascal (350.000–440.000 atm).[4]
Litium nitrida menunjukkan konduktivitas ionik untuk Li+, dengan nilai c. 2×10−4Ω−1cm−1, dan energi aktivasi (intrakristal) c. 0.26eV (c. 24 kJ/mol). Doping hidrogen meningkatkan konduktivitas, sementara doping dengan ion logam (Al, Cu, Mg) mengurangi konduktivitas.[5][6] Energi aktivasi untuk transfer litium melintasi kristal litium nitrida (interkristalin) telah diukur lebih tinggi pada c. 68.5 kJ/mol.[7] Bentuk alfa merupakan semikonduktor dengan sela pita c. 2.1 eV.[4]
Reaksi dengan hidrogen di bawah 300 °C (tekanan 0,5 MPa ) menghasilkan litium hidrida dan litium amida.[8]
Litium nitrida telah diinvestigasi sebagai media penyimpanan gas hidrogen, karena reaksinya dapat balik pada 270 °C. Telah dicapai absorpsi hidrogen mencapai 11,5%(b/b).[9]
Referensi
[sunting | sunting sumber]- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ E. Döneges "Lithium Nitride" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, New York. Vol. 1. p. 984.
- ^ Barker M. G.; Blake A. J.; Edwards P. P.; Gregory D. H.; Hamor T. A.; Siddons D. J.; Smith S. E. (1999). "Novel layered lithium nitridonickelates; effect of Li vacancy concentration on N co-ordination geometry and Ni oxidation state". Chemical Communications (13): 1187–1188. doi:10.1039/a902962a.
- ^ a b Walker, G, ed. (2008). Solid-State Hydrogen Storage: Materials and Chemistry. §16.2.1 Lithium nitride and hydrogen:a historical perspective.
- ^ Lapp, Torben; Skaarup, Steen; Hooper, Alan (October 1983). "Ionic conductivity of pure and doped Li3N". Solid State Ionics. 11 (2): 97–103. doi:10.1016/0167-2738(83)90045-0.
- ^ Boukamp, B. A.; Huggins, R. A. (6 September 1976). "Lithium ion conductivity in lithium nitride". Physics Letters A. 58 (4): 231–233. doi:10.1016/0375-9601(76)90082-7.
- ^ Boukamp, B. A.; Huggins, R. A. (January 1978). "Fast ionic conductivity in lithium nitride". Materials Research Bulletin. 13 (1): 23–32. doi:10.1016/0025-5408(78)90023-5.
- ^ Goshome1, Kiyotaka; Miyaoka2, Hiroki; Yamamoto1, Hikaru; Ichikawa3, Tomoyuki; Ichikawa1, Takayuki; Kojima1, Yoshitsugu (2015). "Ammonia Synthesis via Non-Equilibrium Reaction of Lithium Nitride in Hydrogen Flow Condition". Materials TransactionS. 56 (3): 410–414. doi:10.2320/matertrans.M2014382.
- ^ Ping Chen; Zhitao Xiong; Jizhong Luo; Jianyi Lin; Kuang Lee Tan (2002). "Interaction of hydrogen with metal nitrides and amides". Nature. 420 (6913): 302–304. doi:10.1038/nature01210. PMID 12447436.


