Nitrácia
Nitrácia je elektrofilná substitučná reakcia. Pri nitrácii sa na zlúčeninu zavádza skupina -NO2. Využíva sa veľmi často pri príprave výbušnín ako nitroglycerín, TNT, hexogén a iné.
Aromatická nitrácia
[upraviť | upraviť zdroj]Nitrácia sa najčastejšie uskutočňuje na aromatických systémoch pretože sú dobré donory elektrónov. Aromatické zlúčeniny sa nitrujú zmesou koncentrovanej kyseliny dusičnej a koncentrovanej kyseliny sírovej.[1]
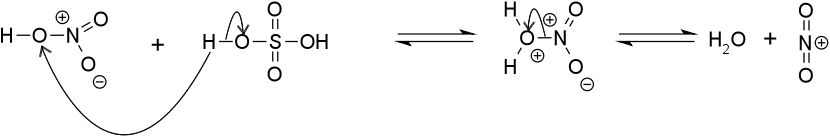
Mechanizmus
[upraviť | upraviť zdroj]Pridaním kyseliny sírovej k dusičnej sa -OH skupina na kyseline dusičnej naprotonuje a odstupuje ako voda. Takto vzniká nitróniový ión NO2+.
Nitróniový katión potom príjme elektrón od nejakého elektrofilu a vzniká tak prechodný komplex, ktorý sa stabilizuje odtrhnutím vodíka vodou.
Prax
[upraviť | upraviť zdroj]Nitrácia je exotermický dej preto sa občas reakčná zmes chladí. Nitrácia môže rádovo trvať až niekoľko hodín. Väčšinou sa po úvodnej exotermickej reakcii reakčná zmes zahrieva na určitú teplotu (záleží od nitrovaného substrátu). Nitrácia benzénu do prvého stupňa (len jedna -NO2 skupina) prebieha pri teplote pod 50°C.[2] Po ukončení reakcie sa väčšinou reakčná zmes premýva destilovanou vodou (ak to umožňuje povaha látky) na odstránenie nezreagovaných kyselín. Pre dostatočný výťažok je potrebné použiť čo najkoncentrovanejšiu kyselinu dusičnú. Tá sa však účinkom svetla a tepla rozkladá. Preto sa často používa namiesto samotnej kyseliny dusičnej nejaká jej soľ, ktorá pri reakcii s H2SO4 uvoľňuje nitróniový katión. Najčastejšie sa používajú KNO3 a NaNO3 ale je možné použiť aj NH4NO3.
Využitie
[upraviť | upraviť zdroj]Priemyselne je nitrácia veľmi dôležitou operáciou. Pomocou nitrácie sa pripravujú hlavne výbušniny, v ktorých je prítomnosť -NO2 skupiny kľúčová. Nitráciou sa však pripravujú aj prekurzory na liečivá a iné látky. -NO2 skupina sa dá pomocou SnCl2 alebo železných pilín v kyslom prostredí zredukovať na -NH2 skupinu.[1]
Referencie
[upraviť | upraviť zdroj]- ↑ a b MCMURRY, John. Organická chemie. Preklad Jaroslav Jonas et al. Vyd. 1. V Brně; V Praze : Vysoké učení technické; Vysoká škola chemicko-technologická, 2007. 1176 s. (Překlady vysokoškolských učebnic; zv. 2.) ISBN 978-80-214-3291-8, 978-80-7080-637-1. S. 533.
- ↑ THE NITRATION OF BENZENE [online]. . Dostupné online.