Nitrate d'hydrazine
| Nitrate d'hydrazine | |
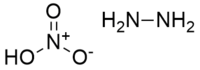
| |
| Structure du nitrate d'hydrazine. | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.033.341 |
| PubChem | 166817 |
| Propriétés chimiques | |
| Formule | N2H4·HNO3 |
| Masse molaire[1] | 95,058 ± 0,001 9 g/mol H 5,3 %, N 44,2 %, O 50,49 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le nitrate d'hydrazine est un composé hygroscopique[2] de formule N2H4·HNO3. Il est utilisé comme oxydant dans des explosifs liquides. Il existe sous deux formes cristallines : la forme stable α et la forme instable β[2].
Synthèse
[modifier | modifier le code]Le nitrate d'hydrazine a été synthétisé pour la première fois en 1989 en Allemagne. Il peut être synthétisé par réaction entre l'hydrazine (anhydre, en solution dans du méthanol) et l'acide nitrique à basse température (température maintenue en dessous de 0 °C). Le recours à l'hydrate d'hydrazine plutôt qu'à l'hydrazine permet de réduire les coûts[2].
Propriété
[modifier | modifier le code]La solubilité du nitrate d'hydrazine est faible dans les alcools mais bien meilleure dans l'eau et l'hydrazine. Il est très hygroscopique, juste un peu moins que le nitrate d'ammonium. Sa perte de poids à 100 °C est plus faible que celle du nitrate d'ammonium. Son point d'explosion est à 307 °C (50 % détonation) et l'énergie d'explosion est de 3,829 MJ/kg.
Les produits de sa détonation sont gazeux et de faible poids moléculaire également car il ne possède pas d'atome de carbone dans sa structure.
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hydrazine nitrate » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Jiping Liu, Liquid explosives, Heidelberg, Springer, , 344 p. (ISBN 978-3-662-45846-4, OCLC 900158052), p. 6.
