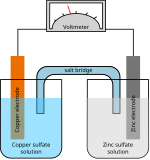
Ogniwo pierwotne
Ogniwo pierwotne – rodzaj ogniwa galwanicznego, które jest jednorazowe, czyli nieładowalne. Ogniwo takie po rozładowaniu, czyli wyczerpaniu się materiału anodowego, nie nadaje się do dalszego użycia w wyniku zaniku jego siły elektromotorycznej. Nie da się go także zregenerować poprzez ładowanie, w przeciwieństwie do ogniwa wtórnego. Ogniwa służą do zasilania drobnych przedmiotów domowego użytku, ale także urządzeń ratunkowych (radia), bądź wojskowych. Najczęściej dostępnymi ogniwami pierwotnymi są ogniwa Leclanchégo, ogniwa alkaliczne oraz ogniwa litowe (których nie należy mylić z ogniwami litowo-jonowymi, które są ładowalne).
Zasada działania
[edytuj | edytuj kod]Ogniwo przechowuje energię na sposób chemiczny i nie wymaga wcześniej włożenia w niego energii elektrycznej przed użyciem, tak jak akumulator elektryczny. Energia elektryczna produkowana przez ogniwo pierwotne jest uwalniana w wyniku spontanicznego zachodzenia reakcji na granicach faz elektroda-elektrolit. Reakcje mogą zajść w wyniku zamknięcia obwodu zewnętrznego, przez co elektrony mogą przepływać między elektrodami, a w wyniku różnicy potencjałów elektrochemicznych między materiałami elektrodowymi (anodą i katodą) poprzez elektrolit dokonuje się przepływ jonów. Elektrony oddawane są przez drobiny biorące udział w reakcji elektrodowej w anodzie (elektrodzie o niższym potencjale elektrochemicznym), które stają się jonami zmieniając swój stopień utlenienia na wyższy i przechodzą do elektrolitu (reakcja utleniania). Jony na katodzie (elektrodzie o wyższym potencjale elektrochemicznym) odbierają elektron i stają się częścią katody w wyniku reakcji katodowej (reakcja redukcji). Elektrolit nie może przewodzić elektronów, gdyż wówczas doszłoby do samorozładowania ogniwa. Elektrolit musi za to dobrze przewodzić jony, gdyż to od przewodnictwa jonów zależy możliwa do uzyskania gęstość prądu z ogniwa.
Parametry
[edytuj | edytuj kod]
Najważniejszym parametrem ogniwa jest jego pojemność mierzona najczęściej w amperogodzinach. Wynika ona ze zgromadzonego materiału anodowego, który może ulec utlenieniu (może w wyniku reakcji utleniania oddać elektron). Sumaryczny ładunek mierzony jest w kulombach (amper razy sekunda) i na potrzeby przeliczenia na amperogodziny trzeba jego wartość podzielić przez 3600. Ładunek można obliczyć ze wzoru:
- Q = m * F * z / M
gdzie: Q – zgromadzony ładunek; m – masa materiału aktywnego materiału elektrodowego; F – stała Faradaya; z – liczba elektronów przeniesionych w jednej reakcji; M – masa molowa aktywnego materiału elektrodowego.
Równie ważnym parametrem jest siła elektromotoryczna ogniwa, określająca wraz z pojemnością przechowywaną w ogniwie energię. Wynika ona z użytych materiałów elektrodowych i różnicy potencjału między nimi. Im większa, tym więcej energii zgromadzonej jest w ogniwie. Energię zgromadzoną w ogniwie można obliczyć jako iloczyn siły elektromotorycznej i ładunku przechowywanego w ogniwie (pojemność). Ze względu na różne efekty poboczne występujące w ogniwie, napięcie w czasie pracy ogniwa jest niższe od teoretycznej siły elektromotorycznej (głównie ze względu na opór wewnętrzny ogniwa). Napięcie w trakcie działania ogniwa nie jest stałe i powoli spada w wyniku polaryzacji układu, zmiany w stężeniu substancji w różnych częściach ogniwa i występowania nadpotencjałów. Także zmiana temperatury ogniwa, bądź jego stref może znacząco wpłynąć na napięcie całego ogniwa.
Maksymalny chwilowy prąd możliwy do pobrania z ogniwa jest również ważnym parametrem, który określa możliwe zastosowania ogniwa lub jak dużo ogniw trzeba spiąć równolegle, aby uzyskać wymagany prąd. Parametr ten wynika z typu ogniwa (materiałów tworzących elektrody), wielkości ogniwa, ale również z rozwinięcia powierzchni elektrod i oporu wewnętrznego ogniwa (w tym przede wszystkim oporu elektrolitu i oporu przeniesienia ładunku).
Trwałość ogniwa jest parametrem określającym tempo korozji elektrod, wpływającym na tempo samorozładowania ogniwa. Ma to zwłaszcza kluczowe znaczenie dla ogniw mających być awaryjnym zasilaniem lub do zasilania sprzętu ratunkowego/awaryjnego. Tempo korozji elektrod wynika z użytych materiałów elektrodowych a także dodatków funkcjonalnych użytych w nich. Nie bez znaczenia jest też skład elektrolitu, zwłaszcza w ogniwach litowych.
Wymiary ogniwa, pomijając oczywiście ich wpływ na możliwą do przechowania w ogniwie energię, mają również znaczenie, gdyż ze względu na standaryzację ogniw, muszą one mieć jeden z odpowiednich kształtów i jeden z zestawów możliwych wymiarów (odpowiednich dla danego kształtu). Najczęstszymi kształtami ogniwa są cylinder i prostopadłościan. W przypadku cylindra mogą być to "baterie" bateria AA lub bateria AAA (zwane popularnie "paluszkami") lub typu guzik. O ile istnieją baterie (czyli obudowy zawierające naraz więcej niż jedno ogniwo) o kształtach cylindrycznych, o tyle znacznie częstsze są pojedyncze ogniwa o takim kształcie, które jedynie potocznie (i nieprawidłowo) nazywa się bateriami. Podobnie ma się rzecz z ogniwami typu guzik.
Materiały
[edytuj | edytuj kod]Istnieje wiele różnych materiałów, z których można zbudować zarówno anody jak i katody. Do materiałów elektrodowych dobiera się odpowiedni elektrolit. Ze względów praktycznych, najczęściej w przemyśle bateryjnym stosuje się materiały stałe zawierające metale, będące związkami metali lub będące czystymi metalami. Dodaje się do nich również często dodatki funkcjonalne poprawiające przewodzenie elektronowe w ramach elektrody (często grafit) lub ułatwiające utrzymanie kształtu elektrod (lepiszcze). Dobór materiałów elektrodowych zwykle opiera się na możliwie największej różnicy potencjałów elektrochemicznych między nimi, co powoduje wzrost przechowywanej energii między nimi. Niekiedy jednak dobór bazuje na kompatybilności wstecznej z istniejącymi typami ogniw. W nielicznych przypadkach materiały elektrodowe mogą być ciekłe lub gazowe. Są to rzadkie przypadki, chociaż z punktu widzenia teorii są równoprawnymi materiałami katodowymi i anodowymi. W praktyce jednak są to wyjątki, np. w przypadku ogniwa cynkowo-powietrznego katodą jest tlen z powietrza a w przypadku ogniwa Li-SO2 jest dwutlenek siarki. Przykładem dla ciekłej elektrody są ogniwa z rtęcią jako katodą (właściwie tylko o historycznym znaczeniu) i ogniwa litowe z ciekłymi katodami (SOCl2 lub SO2Cl2).
Elektrolitem jest najczęściej roztwór związku o charakterze jonowym w rozpuszczalniku polarnym (z wyjątkiem ogniw zawierających lit najczęściej jest to woda). Mogą być to zasady, sole lub kwasy.
Nieaktywnym, ale zwykle niezbędnym elementem ogniwa jest separator, czyli porowaty materiał nasączony elektrolitem rozdzielający elektrody od siebie przeciwdziałając ich mechanicznemu zetknięciu i zwarciu. W przypadku, gdy elektrolitem jest ciało stałe (lub żel), separator jest niepotrzebny.
Typy ogniw
[edytuj | edytuj kod]| Typ ogniwa[a] | Schemat ogniwa | Napięcie ogniwa / V |
|---|---|---|
| ogniwo Bunsena (jedynie o znaczeniu historycznym) | (–) Zn | HNO3, H2SO4 (aq) | C (+) | 1,9 |
| ogniwo Clarka (historyczne) | (–) Zn(Hg) | ZnSO4 (aq) | Hg (+) | 1,4 |
| ogniwo Daniella (historyczne) | (–) Zn | ZnSO4 (aq) || CuSO4 (aq) | Cu (+) | 1,1 |
| ogniwo Volty (historyczne) | (–) Zn | H2SO4 | Cu (+) | 1,1 |
| ogniwo Westona (historyczne) | (–) Cd(Hg), CdSO4 | CdSO4 (aq) | CdSO4, Hg2SO4, Hg (+) | 1,0 |
| ogniwo cynkowo-węglowe (Leclanchégo) | (–) Zn | NH4Cl, ZnCl2 | MnO2, C (+) | 1,5 |
| alkaliczne ogniwo cynkowo-manganowe („bateria alkaliczna”) | (–) Zn | ZnO, KOH(aq) | MnO2, C (+) | 1,55 |
| ogniwo srebrowo-cynkowe | (–) Zn,ZnO | KOH(aq) | Ag2O, C (+) | 1,6 |
| ogniwo cynkowo-powietrzne[b] | (–) Zn | NaOH(aq) | C, O2 (+) | 1,65 |
| ogniwo litowo-manganowe | (–) Li | LiBr[c] w PC lub AN | MnO2 (+) | 3,0 |
| ogniwo litowo-fluorografitowe | (–) Li | LiBF4 w PC | (CFx)n (+) | 3,0 |
| ogniwo Li-SO2 | (–) Li | LiBr, SO2 w AN | C (+) | 3,0 |
| ogniwo Li-SOCl2 | (–) Li | LiClO4, SOCl2 | C (+) | 3,0 |
Uwagi
[edytuj | edytuj kod]Bibliografia
[edytuj | edytuj kod]- Andrzej Czerwiński: Współczesne chemiczne źródła prądu. Wydawnictwa Szkolne i Pedagogiczne. [dostęp 2010-11-07]. (pol.).
- Andrzej Czerwiński: Akumulatory, Baterie, Ogniwa. Wydawnictwa Komunikacji i Łączności, 2005. ISBN 83-206-1564-X. (pol.).
- Adolf Kisza: Elektrochemia II Elektrodyka. Wydawnictwa Naukowo-Techniczne, 2001. ISBN 83-204-2564-6. (pol.).
- Waldemar Ufnalski: Elementy Elektrochemii. Oficyna Wydawnicza Politechniki Warszawskiej, 1996. ISBN 83-87012-13-1. (pol.).