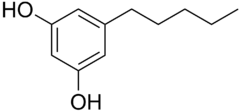
Olivétol
| Olivétol | |
| |
| Identification | |
|---|---|
| Nom systématique | 5-pentylbenzène-1,3-diol |
| Synonymes |
5-pentylrésorcinol, 5-pentylrésorcine, 5-n-amylrésorcinol |
| No CAS | |
| No ECHA | 100.007.190 |
| No CE | 207-908-8 |
| No RTECS | VH2880000 |
| PubChem | 10377 |
| ChEBI | 66960 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche à blanc jaunâtre[1] |
| Propriétés chimiques | |
| Formule | C11H16O2 [Isomères] |
| Masse molaire[2] | 180,243 5 ± 0,010 5 g/mol C 73,3 %, H 8,95 %, O 17,75 %, |
| Propriétés physiques | |
| T° fusion | 46 à 48 °C[3] |
| T° ébullition | 162 à 164 °C (7 hPa)[3] |
| Point d’éclair | 113 °C (coupelle fermée)[3] |
| Précautions | |
| SGH[3] | |
| H302, H315, H318, H400, P273, P280, P301+P312+P330, P302+P352 et P305+P351+P338+P310 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'olivétol aussi connu sous les noms de 5-pentylrésorcinol (5-pentylrésorcine) ou 5-pentylbenzène-1,3-diol est un composé organique de la famille des alkylrésorcines ; c'est plus précisément le dérivé pentylé de la résorcine. On le trouve notamment dans certaines espèces de lichens. C'est un précurseur dans diverses synthèses du tétrahydrocannabinol.
Occurrence
[modifier | modifier le code]
L'olivétol est présent dans certaines espèces de lichens et peut en être extrait facilement[4]. On trouve jusqu'à 2,6 % dans la parmélie grise (Hypogymnia physodes) [5].
L'olivétol est également produit par un certain nombre d'insectes, que ce soit comme phéromone, répulsif ou antiseptique[6],[7].
Le plant de cannabis produit une substance apparentée, l'acide olivétolique (OLA) qui pourrait être impliqué dans la biosynthèse du tétrahydrocannabinol (THC)[8],[9].
Propriétés
[modifier | modifier le code]L'olivétol se présente sous la forme d'une poudre blanche à blanc jaunâtre qui fond vers 46 à 48 °C. Il est faiblement acide du fait de ses groupes hydroxyle phénoliques, et peut être dissout dans des solvants basiques.
Biosynthèse
[modifier | modifier le code]L'olivétol est biosynthétisé par une réaction de type catalysée par une polycétide synthase à partir de l'hexanoyl-CoA et de trois molécules de malonyl-CoA, une aldolisation avec un intermédiaire tetracétide. En 2009, Taura et al. ont réussi à reproduire une polycétide synthase de type III nommée olivétol synthase (OLS) à partir de Cannabis sativa[10]. Cette enzyme est une protéine homodimérique (en), un polypeptide constitué de 385 acides aminés de masse molaire 42 585 Da qui présente une grande similitude de séquence (60-70%) avec l'enzyme naturelle de la plante[10].
Les données de cette étude concernant la cinétique de l'OLS montrent qu'elle catalyse une aldolisation décarboxylative pour produire l'olivétol. C'est un mécanisme similaire à celui de la stilbène synthase (STS) pour convertir la p-coumaroyl-CoA et la malonyl-CoA en resvératrol. Si l'olivétol est la forme décarboxylée de l'acide olivétolique (OLA), il est hautement improbable que l'OLS produise l'olivétol à partir de l'OLA[10],[11]. Les extraits enzymatiques bruts préparés à partir de fleurs et de feuilles ne synthétisent pas l'acide olivétolique, mais produisent seulement de l'olivétol[10]. Le mécanisme exact est encore incertain, mais il est possible qu'un complexe métabolique formant l'OLA se forme avec l'OLS[10]. De plus, il semble que l'OLS n'accepte comme réactifs que les esters de la CoA avec des chaînes aliphatiques de C4 à C8 tels que l'hexanoyl-CoA[10],[12].

Utilisations
[modifier | modifier le code]L'olivétol extrait de la parmélie grise est utilisé dans différents parfums.
Synthèse du THC
[modifier | modifier le code]Le tétrahydrocannabinol (THC) peut être synthétisé par condensation de la pulégone et l'olivétol[13]. Une autre méthode est la condensation entre l'olivetol et l'oxyde de Δ2-carène[14].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Olivetol » (voir la liste des auteurs).
- (en) Robert Turkington, Chemicals Used for Illegal Purposes, John Wiley & Sons, (ISBN 978-0-470-18780-7, lire en ligne), p. 436
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Olivetol, consultée le 24 septembre 2020.
- Sarah K. Oettl, Jana Gerstmeier, Shafaat Y. Khan, Katja Wiechmann, Julia Bauer, Atanas G. Atanasov, Clemens Malainer, Ezzat M. Awad, Pavel Uhrin, Elke H. Heiss, Birgit Waltenberger, Daniel Remias, Johannes M. Breuss, Joel Boustie, Verena M. Dirsch, Hermann Stuppner, Oliver Werz et Judith M. Rollinger, « Imbricaric Acid and Perlatolic Acid: Multi-Targeting Anti-Inflammatory Depsides from Cetrelia monachorum », PLOS ONE, vol. 8, no 10, , e76929 (PMID 24130812, PMCID 3793931, DOI 10.1371/journal.pone.0076929)
- Igor Stojanovic, Niko Radulovic, Tatjana Mitrovic, Slavisa Stamenkovic, Gordana Stojanovic, « Volatile constituents of selected Parmeliaceae lichens », Journal of the Serbian Chemical Society, vol. 76, no 7, , p. 987 (DOI 10.2298/JSC101004087S)
- Attygalle et al. (1989). Journal of Chemical Ecology. (15) 1: 317-28 Chemical composition and function of metapleural gland secretion of the ant,Crematogaster deformis smith (hymenoptera: Myrmicinae)
- The Pherobase (Database pf pheromones and semiochemicals). 5-Pentylresorcinol. Retrieved 18 January 2014
- I Hassuni et H Razxouk, « Olivetol: Constituent of lichen Evernia prunastri Ach. or "oakmoss" », Physical and Chemical News, vol. 26, , p. 98–103 (lire en ligne)
- Igor Stojanovic, Niko Radulovic, Tatjana Mitrovic, Slavisa Stamenkovic et Gordana Stojanovic, « Volatile constituents of selected Parmeliaceae lichens », Journal of the Serbian Chemical Society, vol. 76, no 7, , p. 987–94 (DOI 10.2298/JSC101004087S)
- Futoshi Taura, Shinji Tanaka, Chiho Taguchi, Tomohide Fukamizu, Hiroyuki Tanaka, Yukihiro Shoyama et Satoshi Morimoto, « Characterization of olivetol synthase, a polyketide synthase putatively involved in cannabinoid biosynthetic pathway », FEBS Letters, vol. 583, no 12, , p. 2061–6 (PMID 19454282, DOI 10.1016/j.febslet.2009.05.024)
- Tri J Raharjo, Wen-Te Chang, Young Hae Choi, Anja M.G Peltenburg-Looman et Robert Verpoorte, « Olivetol as product of a polyketide synthase in Cannabis sativa L », Plant Science, vol. 166, no 2, , p. 381–5 (DOI 10.1016/j.plantsci.2003.09.027)
- Tri J. Raharjo, Wen-Te Chang, Marianne C. Verberne, Anja M.G. Peltenburg-Looman, Huub J.M. Linthorst et Robert Verpoorte, « Cloning and over-expression of a cDNA encoding a polyketide synthase from Cannabis sativa », Plant Physiology and Biochemistry, vol. 42, no 4, , p. 291–7 (PMID 15120113, DOI 10.1016/j.plaphy.2004.02.011)
- U. Claussen, P. Mummenhoff, F. Korte, « Haschisch—XVIII », Tetrahedron, vol. 24, no 7, , p. 2897 (DOI 10.1016/s0040-4020(01)98697-1)
- US 3734930, Razdan, Raj Kumar & Handrick, Richard G., "DIRECT SYNTHESIS OF (-)-TRANS-Δ TETRAHYDROCANNABINOL FROM OLIVETOL AND (+)-TRANS-Δ-CARENE OXIDE"



