Ostrygojad czarny
| Haematopus bachmani[1] | |||
| Audubon, 1838 | |||

| |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Parvordo | |||
| Nadrodzina | |||
| Rodzina | |||
| Podrodzina | |||
| Rodzaj | |||
| Gatunek |
ostrygojad czarny | ||
| Synonimy | |||
| |||
| Zasięg występowania | |||
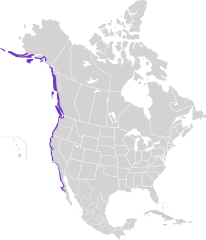
| |||
Ostrygojad czarny[2] (Haematopus bachmani) – gatunek średniej wielkości ptaka z rodziny ostrygojadów (Haematopodidae). Występuje wzdłuż zachodniego wybrzeża Ameryki Północnej od Aleutów po Kalifornię Dolną. Stosunkowo słabo poznany w porównaniu do innych ostrygojadów. Nie wszystkie autorytety uznają jego odrębność od ostrygojada czarniawego (H. ater) lub zwyczajnego (H. ostralegus). Z tego powodu nie jest obecnie (2022) klasyfikowany przez IUCN; wcześniej uchodził za gatunek najmniejszej troski (LC).
Taksonomia
[edytuj | edytuj kod]Po raz pierwszy gatunek opisał John James Audubon w 1838. Holotyp pochodził z ujścia rzeki Kolumbia. Autor nadał nowemu gatunkowi nazwę Haematopus Bachmani[3]. Epitet gatunkowy upamiętnia Johna Bachmana, współpracownika Audubona[4].
Obecnie (2022) Międzynarodowy Komitet Ornitologiczny podtrzymuje tę nazwę i umieszcza ostrygojada czarnego w rodzaju Haematopus jako odrębny monotypowy gatunek[5]. Jego pozycja jest jednak sporna. Za osobny gatunek uznają go również autorzy Clements Checklist of Birds of the World (sierpień 2021)[6], Howard and Moore Complete Checklist of the birds of the World (2014)[7]. Na liście ptaków świata opracowywanej we współpracy BirdLife International z autorami HBW (6. wersja online: grudzień 2021) ostrygojad czarny został uznany za jeden z dwóch podgatunków ostrygojada czarniawego (H. ater)[8]. Przez to nie jest klasyfikowany przez IUCN, które uznaje system klasyfikacji uznawany przez BirdLife International.
Filogeneza
[edytuj | edytuj kod]Jetz et al. (2012) uwzględnili 8 taksonów, przy czym w rodzinie jest 11 gatunków; wzajemne relacje między nimi przedstawia poniższy kladogram[9]:
| |||||||||||||||||||||||||||||||||||||||||||
Linie rozwojowe kladu H. palliatus+H. bachmani oraz H. ater rozdzieliły się blisko 2,11 mln lat temu, a ostrygojada czarnego i ostrygojada brunatnego – około 0,816 mln lat temu[9]. U Senfel i innych (2020) ostrygojad czarny zamiast gatunkiem siostrzanym wobec ostrygojada brunatnego okazał się gatunkiem siostrzanym wobec kladu H. ater+H. palliatus[10]. Odrębność gatunkowa ostrygojadów brunatnych i czarnych została wstępnie potwierdzona już w latach 90. XX wieku (co najmniej do 1995 wyniki tych badań nie zostały opublikowane)[4].
Ostrygojady brunatne i czarne mogą się krzyżować; obszary ich występowania nakładają się na mierzącym blisko 480 km odcinku wybrzeża w Kalifornii Dolnej[4][11]. Częstotliwość krzyżowania się H. palliatus i H. ater była stosunkowo wysoka w latach 20. i 30. XX wieku. Strefa hybrydyzacji tych dwóch ostrygojadów jest miejscem ich wtórnego kontaktu – powstały one w procesie specjacji allopatrycznej. W połowie lat 80. XX wieku w licznych subpopulacjach znów przeważały osobniki czyste gatunkowo. Tymczasowa zmiana proporcji – jej przyczyn wówczas nie znano – świadczy o tym, że preferowane jest kojarzenie selektywne[11].
Morfologia
[edytuj | edytuj kod]
Długość ciała wynosi 42–47 cm[4]; masa ciała – u samców 555–648 g, u samic 618–750 g. Samice są przeciętnie większe z dłuższym i cieńszym dziobem[12] (jego długość ogółem wynosi blisko 6,5–8,5 cm)[4]. Ostrygojady czarne to jedyne północnoamerykańskie siewkowce z całkowicie ciemnym upierzeniem. Wśród nich występuje zmienność ubarwienia o charakterze klinowym. Osobniki z populacji gniazdującej od Alaski do okolic Oregonu są głównie czarne. Im dalej na południe, tym bardziej brązowy jest spód ciała i tym częściej można obserwować osobniki z pojedynczymi białymi piórami[4].
Ostrygojady czarne mają jednolicie ciemne upierzenie, lecz nie czarne. Grzbiet ma barwę czarniawobrązową, podobnie jak u wszystkich ostrygojadów Nowego Świata oprócz magellańskich (H. leucopodus). Ostrygojady czarne są bardzo podobne do czarniawych (H. ater), wyróżniają się nieznacznie krótszymi skrzydłami (złożone nie dosięgają końcem do końca ogona), mniej krępą budową ciała i nieco ciemniejszymi nogami. Długość dzioba jest zbliżona, jednak wysokość dzioba mniejsza u ostrygojadów czarnych, zwłaszcza w okolicy podcięcia żuchwy. Osobniki młodociane odróżniają płowe krawędzie piór. U dorosłych osobników tęczówka ma barwę żółtą, obrączka oczna – pomarańczowoczerwoną, a nogi – jasnoróżową. U osobników młodocianych obrączka oczna jest pomarańczowobrązowa (podobnie jak dziób) i bardziej matowa, nogi natomiast – szare, różowawe[12].
Zasięg występowania
[edytuj | edytuj kod]Obszar występowania ostrygojadów czarnych rozciąga się wzdłuż wybrzeża Oceanu Spokojnego: od Aleutów (na zachód po Kiska) i środkowej Alaski po północno-zachodni Meksyk (środkowa Kalifornia Dolna i Wyspy Coronado)[7]. Rozciągłość południkowa zasięgu ich występowania to około 32° (blisko 3550 km), od Zatoki Bristolskiej na szerokości 59°N do Punta Abreojos na 27°N; jego rozciągłość równoleżnikowa to blisko 55° (między 179°W a 114°W)[13]. Zagęszczenie populacji ostrygojadów czarnych jest nierównomierne. Według danych z 2014 około 55–80% z nich gniazduje u wybrzeży Alaski, a 10–20% – Kolumbii Brytyjskiej[14]. Większość zimuje jednak na południe od południowej Kolumbii Brytyjskiej[12]. Część populacji z Alaski i Kolumbii Brytyjskiej jest osiadła. Co najmniej do 2010 rozmieszczenie ostrygojadów czarnych poza okresem lęgowym było słabo poznane[15].
Lokalne populacje ostrygojadów czarnych zostały wytępione na niektórych przybrzeżnych wyspach Kalifornii Dolnej i Alaski. Na Wyspach Farallońskich były jedynie rzadko obserwowane przez blisko 100 lat, aż do odnotowania pierwszych lęgów w 1972; przystąpiły do nich po pozbyciu się z wysp kotów i zmniejszeniu niepokojenia ze strony ludzi. Poszerzenie obszaru gniazdowania w skali lokalnej zauważono w Strait of Georgia, Zatoce San Francisco i w południowej Kalifornii[16]. Ostrygojady czarne skolonizowały Middleton Island (Alaska) prawdopodobnie w 1976. Wybrzeże wyspy zostało przekształcone po trzęsieniu ziemi w 1964; w 1976 dostrzeżono pierwszą parę, a liczebność populacji zaczęła gwałtownie wzrastać w latach 90. XX wieku[17].
Pożywienie
[edytuj | edytuj kod]Ostrygojady czarne żywią się wyłącznie bezkręgowcami żyjącymi w strefie pływów. Szczególnie istotne w ich diecie są omułki (Mytilus)[12] (zwłaszcza M. californianus i M. trossulus[4]), ślimaki żyjące na skałach (skałoczepy; między innymi Diadora aspera[14] i Lottia[18] oraz czareczki, Puncturella), Nucella (rozkolcowate), Littorina oraz chitony – Katharina tunicata, Tonicella lineata i Mopalia. Mimo że pod względem liczbowym największy udział w zdobyczy mają niewielkie ślimaki, to największy odsetek biomasy stanowią małże[14]. Ostrygojady czarne zjadają również kraby (między innymi Emerita analoga[4], Oedignathus enermis[19] i Hemigrapsus[18]), jeżowce, równonogi i wąsonogi[4]. Na Wyspach Farallońskich wśród dostarczanego pisklętom pożywienia stwierdzono również wstężnice i wieloszczety (potocznie i nieprecyzyjnie nazywane robakami morskimi) oraz larwy chrząszczy z rodziny czarnuchowatych rozwijające się w glebie[20].
Bergman i inni (2013) przeprowadzili dotychczas najdokładniejsze i najszerzej zakrojone badania nad składem pożywienia ostrygojadów czarnych. W Strait of Georgia (Kolumbia Brytyjska) nie wykazano znaczących różnic w składzie pożywienia w poszczególnych latach (2004–2010). Pod względem liczbowym skałoczepy stanowić mogły 50–75%, omułki – 14–34%, chitony – 8–18%, ślimaki morskie Haliotis kamtschatkana – 1–2%, a pozostałe organizmy – poniżej 1% zdobyczy. Dwie dekady wcześniej ogólny skład pożywienia pod względem proporcji był podobny. W okresie 2004–2010 na 99 terytoriach lęgowych (łącznie; nie wszystkie uwzględniano co roku) zebrano 18222 sztuki zdobyczy. Skałoczepy stanowiły około 57,5%, omułki – 26,3%, chitony – 13,5%, H. kamtschatkana – 0,8%, pozostałe – 1,8% (kraby, małże, wąsonogi, turbany oraz po jednym jeżowcu i przegrzebku)[19]. Hazlitt i inni (2002) zidentyfikowali 1620 sztuk zdobyczy dostarczanej pisklętom. Skałoczepy stanowiły 70%, chitony – 12%, wąsonogi – 13%, pozostałe – 5% sztuk zdobyczy; ich szacunkowy udział w łącznej wartości energetycznej (kJ) zdobyczy to odpowiednio 70%, 20%, 9% i 2%[18].
Typ wybrzeża ma wpływ na skład pożywienia ostrygojadów czarnych. W Zatoce Księcia Williama (Alaska) największy udział w ich diecie mają kolejno: na podłożu kamienistym – skałoczepy, omułki M. trossulus i chitony; na podłożu piaszczysto-żwirowym – skałoczepy, omułki M. trossulus i Modiolus modiolus; na częściowo osłoniętym skalistym wybrzeżu – małże, omułki M. trossulus i M. modiolus; na nagim skalistym podłożu – chitony, skałoczepy i omułki M. trossulus. Wśród ostrygojadów czarnych ze środkowej Kalifornii brak sezonowej zmienności składu pożywienia. W Zatoce Księcia Williama zimą skupiają się one na obszarach o większym zagęszczeniu omułków[4]. W Strait of Georgia nie stwierdzono, by dany rodzaj zdobyczy miał tym większy udział w diecie ostrygojadów czarnych, im bardziej jest rozpowszechniony na ich terytorium[19].
Ekologia i zachowanie
[edytuj | edytuj kod]
Preferencje środowiskowe
[edytuj | edytuj kod]Ostrygojady czarne gniazdują na skalistych wybrzeżach i wysepkach. Poza sezonem lęgowym przebywają na skalistych wybrzeżach oraz wattach[12]. W Kolumbii Brytyjskiej co najmniej do 1990 odnotowywano miejsca gniazdowania jedynie na przybrzeżnych skalistych wysepkach (nie części kontynentalnej)[21]. W skali całego obszaru występowania ostrygojady czarne preferują skaliste wybrzeża w strefie pływów ze znacznymi różnicami poziomu wody. Ponieważ żywią się wyłącznie żyjącymi w tej strefie bezkręgowcami i są zależne od wybrzeża, stanowią gatunek wskaźnikowy[14]. Przykładem może być odnotowanie wśród ich zdobyczy zagrożonych ślimaków morskich H. kamtschatkana dopiero w 2004 w Strait of Georgia. W tej samej części Kolumbii Brytyjskiej badano skład pożywienia ostrygojadów czarnych już w 1. połowie lat 90. XX wieku. Pozostałości H. kamtschatkana wśród zdobyczy nie wykazano, a liczebność populacji tych ślimaków wówczas zmniejszała się pomimo wprowadzenia zakazu połowów. Być może pojawienie się ich w diecie ostrygojadów czarnych świadczyło o niespodziewanym wzroście liczebności[19].
W Zatoce Księcia Williama zagęszczenie par jest większe na wybrzeżach niskich. Na odcinkach zdominowanych przez wybrzeża strome zagęszczenie wzrastało wraz z udziałem plaż piaszczysto-żwirowych oraz wraz z liczbą skał i niewielkich wysepek[22]. Zagęszczenie gniazdujących par jest tym mniejsze, im gęstsza jest okrywa roślinna na danym obszarze[4]. Negatywnie wpływa na nią również zbyt wysoka temperatura wody – ogranicza dostępność pożywienia, przez co ostrygojady mogą być w niewystarczająco dobrej kondycji, aby przystąpić do lęgów[23]. Południowa granica zasięgu występowania ostrygojadów czarnych przebiega przez odcinek wybrzeża, na którym przeważać zaczynają piaszczyste plaże[11].
O podejmowaniu wędrówek lub zimowaniu blisko miejsc gniazdowania prawdopodobnie decyduje dostępność pożywienia. Co najmniej do 2010 nie poznano dokładnie czynników na nią wpływających w Zatoce Księcia Williama, wzdłuż której wybrzeża występuje częściowo wędrowna populacja. Na wyspie Kodiak (zamieszkanej przez osiadłą populację) dzięki Prądowi Alaski panuje stosunkowo łagodny klimat w porównaniu do miejsc na podobnej szerokości geograficznej[15].
Tryb życia i zachowanie
[edytuj | edytuj kod]Ostrygojady czarne są monogamiczne (również w znaczeniu społecznym), a stopień przywiązania zarówno do partnera, jak i miejsca gniazdowania[15][24] i zimowania jest stosunkowo wysoki[15]. Ich terytoria lęgowe mają wyraźnie zaznaczone granice, a w ich obrębie mieszczą się zarówno żerowiska, jak i miejsce gniazdowania[4]. Rzadko widywane są dalej niż 100 m od wybrzeża[25]. Czas spędzany na poszczególnych aktywnościach różni się w zależności od okresu w roku i płci. Badane w Kolumbii Brytyjskiej osobniki w okresie poprzedzającym gniazdowanie spędzały 41% czasu na żerowaniu, 25–30% – stojąc, 10–11% – siedząc, 11–12% – czyszcząc upierzenie, 2–3% – na konfliktach z innymi ostrygojadami, a 2–4% – na budowie gniazda[26]. Te obserwowane w hrabstwie Sonoma (północna Kalifornia) przeciętnie spędzały na żerowaniu więcej czasu jesienią i zimą (39%) niż wiosną i latem (26%)[4].
Ostrygojady czarne z populacji gniazdującej w południowej części Alaski i w Kolumbii Brytyjskiej często podejmują średniej lub znacznej długości (powyżej 200 km) wędrówki[15]. Szacunkowo około 75% osobników gniazdujących na Alasce jest wędrowne. Zagęszczenie ostrygojadów czarnych w Kolumbii Brytyjskiej może się podwajać na jesieni, kiedy na zimowiska docierają ptaki gniazdujące na Alasce[27]. Wyspy Kodiak i Vancouver zamieszkują osiadłe populacje. Ostrygojady z części Zatoki Księcia Williama, Middleton Island i Juneau są wędrowne i po sezonie lęgowym przemieszczają się na 130 do około 1700 km[15]. W Parku Narodowym Pacific Rim na wyspie Vancouver ostrygojady czarne w zimie nie wydają się utrzymywać terytoriów, chociaż przebywają blisko swoich terenów lęgowych lub na nich[14][15].
Lęgi
[edytuj | edytuj kod]Okres lęgowy
[edytuj | edytuj kod]Okres składania jaj przypada w większości na maj i czerwiec. W południowych częściach zasięgu ostrygojady czarne przystępują do lęgów przeciętnie o 2 tygodnie wcześniej niż na Alasce[12][13], a w Kolumbii Brytyjskiej i Waszyngtonie – około tygodnia później niż na Wyspach San Juan i w Cieśninie Juana de Fuca[13]. W Kolumbii Brytyjskiej okres składania jaj trwa od 1 maja do 19 sierpnia, przy czym niemal połowa zniesień przypada na okres od 2 do 24 czerwca (53% z n=1371). Prawdopodobnie w niektórych latach pojawiają się już pod koniec kwietnia[21]. W Monterey Bay większość zniesień, łącznie z lęgami zastępczymi, przypada na 2. połowę maja[28].
Gniazdo
[edytuj | edytuj kod]
W okresie poprzedzającym składanie jaj samice są częściej od samców zajęte żerowaniem, natomiast samce wykazują się większą agresją i czujnością niż w pozostałych okresach sezonu lęgowego[26]. Gniazdo ostrygojadów czarnych ma formę płytkiego zagłębienia w podłożu. Zwykle wyściełane jest drobnymi kamykami i fragmentami muszli[12]. Wyściółką mogą być też fragmenty skorupy krabów, naniesionego przez wodę drewna i innej materii oraz trawy[21]. Może być umieszczone w naturalnym zagłębieniu wśród skał albo na podłożu żwirowym lub torfowym[12]. Średnica i głębokość gniazda są wysoce zmienne; w jednym badaniu wyniosły odpowiednio 20,5 cm oraz 2,8 cm[4]. Średnica ogółem wynosi 15–24 cm[29]. Ostrygojady czarne zazwyczaj unikają zakładania gniazda wśród roślinności. Ochronę przed wiatrem i dostrzeżeniem przed drapieżniki może zapewnić umieszczenie go za kępą roślinności, kłodą lub kamieniem. Przygotowywanie gniazda zaczynają 1–3 tygodnie przed złożeniem jaj[4]. W Kolumbii Brytyjskiej większość gniazd umieszczona jest do kilku metrów powyżej linii średniego poziomu morza w trakcie przypływu; niektóre znajdują się do 8,5 m powyżej[21].
Zagęszczenie gniazdujących ostrygojadów czarnych kształtuje się na poziomie 0,03–9,85 pary na kilometr wybrzeża. Pary lęgowe są rzadziej rozmieszczone wzdłuż bardziej skalistych północnych wybrzeży, na przykład w Strait of Georgia – średnio 0,06 pary/km i w zachodniej Zatoce Księcia Williama – 0,03–0,38 pary/km[14]. Podczas 9 lat badań na Triangle Island odnotowano zagęszczenie 2,23–3,72 pary na kilometr wybrzeża[30]. Największe zagęszczenia odnotowuje się na niewielkich wyspach z licznymi dobrze osłoniętymi żerowiskami i małą liczbą drapieżników, między innymi Destruction Island (Waszyngton) – 4,56 par/km i Middleton Island – 9,85 par/km[14]. Na wyspach może zdarzyć się gniazdowanie w luźnych koloniach. Przykładowo w 1971 na Cleland Island o powierzchni 7,7 ha gniazdowało 57 par ostrygojadów czarnych[21]. Daje to około 0,135 ha na parę (powierzchnia nieznacznie mniejsza niż kwadratu o boku 37 m).
Jaja
[edytuj | edytuj kod]Zniesienia ostrygojadów czarnych zazwyczaj zawierają 2 lub 3 jaja, zależnie od regionu i okresu[12]. Ogółem składają się z 1 do 5 jaj, jednak 4 lub 5 jaj zdarza się bardzo rzadko (część źródeł podaje 4 jako górną granicę). Przykładowo z 1371 zniesień z Kolumbii Brytyjskiej daną liczbę jaj zawierało odpowiednio: 1 – 288 (21,0%); 2 – 660 (48,1%); 3 – 419 (30,6%); 4 – 3 (0,2%); 5 – 1 (<0,1%)[21]. 310 zniesień z Cleland Island: 1 – 61 (19,7%), 2 – 176 (56,8%), 3 – 73 (23,5%)[31]. Co najmniej do 1991 nie wykazano jednak znaczących różnic w wielkości zniesienia w różnych częściach zasięgu[13]. Wymiary średnie: 55,22 ± 2,34 mm × 38,60 ± 1,44 mm (n=482)[4].
Wysiadywanie i opieka nad młodymi
[edytuj | edytuj kod]
Wysiadywanie u ostrygojadów czarnych trwa od 24 do 33 dni[12] (zazwyczaj 26–28 dni). Wydłuża się przy niepokojeniu ze strony człowieka. Rozpoczyna się po złożeniu ostatniego jaja[4]. U samców zachowania agresywne utrzymują się przez cały okres wysiadywania, samice zaś stają się spokojniejsze po złożeniu jaj. Na początku wysiadywania więcej czasu poświęcają na nie samice, lecz z czasem udział samca i samicy staje się niemal równy[26]. Zmiany na gnieździe zdarzają się dość często. Podczas odpływu i dogodniejszej okazji do żerowania zaobserwowano 3 zmiany w ciągu 3 godzin. Zazwyczaj ostrygojady czarne zastępują partnera po pojawieniu się bodźca zewnętrznego – innego osobnika swojego gatunku, pojawieniu się drapieżnika lub własnego partnera. Czasami same go wołają, prawdopodobnie z głodu[4].
Sukces klucia jest wysoce zmienny między miejscami gniazdowania i w ich obrębie w poszczególnych latach. Z badań opublikowanych do 2014 wynika, że roczny sukces klucia w różnych miejscach to 12–90%[14]. 2–3 dni przed wykluciem na skorupce pojawiają się pęknięcia o gwieździstym kształcie. Pisklęta zaczynają się wówczas odzywać. Klują się w odstępie 4–6 godzin, niekoniecznie zgodnie z kolejnością składania jaj. Po wykluciu się pisklęta ostrygojadów czarnych ważą 32–36 g. Po blisko 3 dobach potrafią już dobrze chodzić i pływać[4]. Ich typową strategią obronną jest przykucnięcie i zamarcie w bezruchu, aż zagrożenie nie minie. Potrafią również pływać pod wodą (informacje o tej strategii opublikowano dopiero w 1994)[32]. Pisklętami ostrygojadów czarnych zajmują się oboje rodzice. Zaczynają łapać owady około 5. dnia życia, a do około 30. – mięczaki. Są dosyć aktywne, jednak zaczynają podążać za rodzicami dopiero w wieku 3–5 tygodni. Po 5 tygodniach życia są już zdolne do lotu[29].
Wzrost młodych można zobrazować krzywą Gompertza. Ich przyrost masy ciała jest szybszy niż przyrost długości dzioba i skoku. Między 14. a 21. dniem życia pisklęta osiągają największe przyrosty – około 9% docelowej masy ciała dziennie. Młode, które do 20. dnia życia osiągnęły masę co najmniej 200 g, mają większą szansę na dożycie opierzenia niż te o mniejszej masie ciała. Na przyrosty ma wpływ wielkość lęgu oraz hierarchia w jego obrębie. Pisklęta wychowujące się samotnie w wieku 14 dni mają przeciętnie większą masę ciała niż te z lęgów z dwoma młodymi[4].
Ostrygojady czarne przystępują do rozrodu po raz pierwszy w wieku 4–5 lat[33].
Status i zagrożenia
[edytuj | edytuj kod]IUCN nie klasyfikuje ostrygojada czarnego[34], a jego populacja w systematyce uznanej przez organizację należy do ostrygojada czarniawego. Ten jest uznawany za gatunek najmniejszej troski (LC, Least Concern). BirdLife International ocenia trend liczebności jego populacji za trudny do określenia całościowo, jednak w przypadku ostrygojada czarnego – za stabilny[35].
Stan i liczebność populacji
[edytuj | edytuj kod]Tempo zmian liczebności globalnej populacji oszacowane w 2018 sugeruje, że jej trend jest stabilny. Spadek lub wzrost liczebności zachodzi jedynie na poziomie lokalnym[36]. Populacja ostrygojada czarnego liczyła wówczas około 15 tysięcy osobników[37]. W 2014 opublikowano wyniki oceny stanu światowej populacji ostrygojada czarnego. Wówczas populacja lęgowa mogła liczyć od 8,3 do 12,5 tysiąca osobników. Dane dla niektórych regionów nie były jednak aktualne: dotyczące populacji z Kalifornii opublikowano w 1980, z Kolumbii Brytyjskiej – 1985 i 1990, z większości Alaski – 1995 (z części środkowo-wschodniej również 2004), z Kalifornii Dolnej – 2009, a z Waszyngtonu i Oregonu – w 2012[14]. Blisko 15 tysięcy osobników to niemal dwukrotnie więcej, niż szacowano w 1994. Zmiana nie wynika jednak ze zwiększenia się populacji, a ze stosowania coraz lepszych metod oceny liczebności[37][14]. Stosowane dotychczas metody liczeń nie były odpowiednimi do liczenia ostrygojadów. W 2014 opublikowano wyniki oceny liczebności ostrygojadów czarnych w Kalifornii, przy której wykorzystano inną, ulepszoną metodykę. Szacowana liczebność populacji H. bachmani w tym stanie okazała się być blisko 6 razy większa, niż dotąd uważano. Prawdopodobnie również i w innych stanach lub prowincjach zastosowanie lepszej metodyki doprowadziłoby do uzyskania większych liczebności niż dotychczas szacowane[37][16].
Co najmniej do 2021 nie stwierdzono spadku liczebności populacji ostrygojada czarnego. Mimo tego w kilku programach ochrony ptaków morskich został uwzględniony jako gatunek wymagający szczególnej ochrony ze względu na stosunkowo niewielką liczebność populacji oraz ograniczony obszar występowania. Monitoring populacji lęgowej H. bachmani jest prowadzony przez liczne organizacje i agencje rządowe, między innymi US Forest Service, National Park Service, California State Parks, Audubon Society of Portland oraz Parks Canada[38].
W poniższej tabeli przedstawiono najaktualniejsze dostępne w połowie 2022 dane dotyczące liczebności ostrygojadów czarnych. Datę publikacji oraz okres zbierania danych podano osobno.
| Państwo | Stan lub prowincja | Liczebność populacji
(liczba osobników i przedział) |
Lata badań | Data publikacji | Źródło | Status | Uwagi |
|---|---|---|---|---|---|---|---|
| Alaska | 3000–10000 | — | 2019 | [25] | S2S3B,S2N (2019) | Trend liczebności w 2019 był prawdopodobnie stabilny, jednak ze względu na brakujące dane z niektórych części Alaski trudny do określenia; zmiany w rozpowszechnieniu populacji wówczas były nieznane[25] | |
| Kolumbia Brytyjska | 2000–4000 | 2005–2006 | 2015 | [39] | S4 (2015)[40] | Brak dokładnych informacji o stanie populacji całej Kolumbii Brytyjskiej. Założenie, że jej liczebność nie zmieniła się znacząco od lat 80. XX wieku, jest oparte na wynikach badań nad populacją gniazdującą u wybrzeża Salish Sea. Duża część ostrygojadów czarnych w Kolumbii Brytyjskiej gniazduje w dość odległych i trudno dostępnych miejscach[39] | |
| 2000
4000? |
— | 1990 | [21] | Niemal 1000 par, znane blisko 320 miejsc gniazdowania w 1990[21]; część źródeł podaje zakres od 1000 do 2000 par[14] powołując się na dwie publikacje, w których wspomniane jest jednak 1000 par[11][21] | |||
| Waszyngton | 321 (262–511) | 2006 | 2012 | [41] | S4 (2017)[42] | ||
| Oregon | 506 (463–560) | 2016 | 2020 | [43] | S3 (2013)[44] | ||
| 629 (548–743) | 2015 | ||||||
| 311 (276–382) | 2006 | 2012 | [41] | ||||
| Kalifornia | 4749–6067 | 2011 | 2014 | [16] | S4 (2016)[45] | ||
| Kalifornia Dolna | 80 | — | 2009 | [14] | — | Dane pochodzą z niepublicznego raportu[14] | |
| populacja światowa | około 15 000 | — | 2018 | [37] | NE (2022) | ||
| 8300–12500 | — | 2014 | [14] | ||||
| 6900–10800 | — | 2010 | [46] | ||||
| Objaśnienia statusów (S – status dla populacji stanowej): S1 – critically imperiled, S2 – imperiled, S3 – vulnerable, S4 – apparently secure, S5 – secure; B – populacja lęgowa, N – populacja nielęgowa | |||||||
W 2018 opracowano model dynamiki liczebności populacji ostrygojadów czarnych. Jeżeli w populacji lokalnej średnia roczna przeżywalność osobników w 1. roku życia i dorosłych jest typowa, to produkcja młodych na parę powyżej 65% jest korzystna, a poniżej 35% – niepokojąca[36]. Sukces klucia i produkcja młodych różnią się znacznie zarówno między różnymi miejscami gniazdowania, jak i w poszczególnych latach w obrębie jednego miejsca[14]. Przykładowo w hrabstwie San Luis Obispo produkcja młodych na parę w latach 2012–2020 wynosiła 13–95% (średnio 40%, n=8); jest to odsetek młodych, który dożył opierzenia przeliczony na parę. Produkcja młodych na gniazdo (łącznie z lęgami zastępczymi; nie dotyczy jedynie gniazd z sukcesem) wynosiła 11–91% (średnio 34%; n=8). Odsetek gniazd z sukcesem (co najmniej jedno młode dożyło opierzenia) w całym podanym okresie wyniósł 23% (uwzględniając lęgi zastępcze), a par z sukcesem – 27%[47].
Na wzrost liczebności populacji szczególny wpływ mają zmiany w sukcesie klucia, sukcesie lęgowym (tu: odsetku młodych, które dożyły opierzenia) oraz średniej rocznej przeżywalności osobników dorosłych przystępujących do lęgów[36]. Przykładem może być sytuacja populacji lęgowej z Middleton Island. W 2004 odnotowano tam najwyższy – w porównaniu do reszty alaskańskiej populacji – sukces lęgowy oraz najwyższe zagęszczenie par lęgowych. Warunki na wyspie są szczególnie korzystne dla ostrygojadów czarnych: niewiele drapieżnych ptaków, brak drapieżnych ssaków, stosunkowo duża powierzchnia odpowiednich siedlisk lęgowych, rzadkie wymywanie gniazd przez przypływ lub podczas sztormu oraz niewiele niepokojenia ze strony człowieka[17].
Zagrożenia
[edytuj | edytuj kod]Główną przyczyną utraty jaj i piskląt jest drapieżnictwo. Pisklęta są najbardziej narażone w pierwszych 2 tygodniach życia[4]. Na Alasce do drapieżników zjadających jaja ostrygojadów czarnych należą: wizon amerykański (Neogale vison), kuna amerykańska (Martes americana), wydrak kanadyjski (Lontra canadensis), kałan morski (Enhydra lutris), rosomak tundrowy (Gulo gulo), lis rudy (Vulpes vulpes), niedźwiedź brunatny (Ursus arctos) i czarny (U. americanus), mewa lodowa (Larus glaucescens), wrona alaskańska (Corvus caurinus) oraz kruk zwyczajny (C. corax)[14]. W południowej części zasięgu są to również: szop pracz (Procyon lotor), skunks zwyczajny (Mephitis mephitis) oraz udomowione lub dziko żyjące psy i koty. W Kalifornii Dolnej prawdopodobnie jaja ostrygojadów czarnych padają ofiarą kotów i kojotów preriowych (Canis latrans)[14].
Do pozostałych zagrożeń dla populacji ostrygojadów czarnych – zarówno już zaobserwowanych, jak i potencjalnych – należą:
- Zanieczyszczenia wybrzeża, szczególnie wycieki ropy naftowej z tankowców, zagrażają ostrygojadom czarnym na całym obszarze występowania. Możliwym zagrożeniem są również wycieki ropy i paliwa ze statków towarowych[14].
- W południowej części zasięgu występowania ostrygojady są narażone na konsekwencje postępującej urbanizacji: intensywniejszy ruch statków oraz zanieczyszczenia przemysłowe i komunalne[14].
- Regularne wymywanie jaj podczas przypływu lub przez wysokie fale. Szczególnie są na to narażone lęgi w północnej części zasięgu, gdzie większość gniazd umiejscowiona jest na żwirowych plażach na łagodnie nachylonym terenie oraz na platformach abrazyjnych[14].
- Rosnąca presja ze strony człowieka związana z rekreacją na obszarach gniazdowania ostrygojadów czarnych lub obok nich. W Parku Narodowym Kenai Fjords na początku 1. dekady XXI wieku nie zauważono obniżenia sukcesu lęgowego wskutek mało intensywnej działalności rekreacyjnej, głównie spływów kajakowych[48]. Jest jednak możliwe, że w bardziej izolowanych częściach zasięgu obecność obozowiczów, kajakarzy i rybaków na wybrzeżu wiąże się z przypadkowym zadeptywaniem gniazd i jaj oraz niepokojeniem żerujących lub zajmujących się pisklętami ostrygojadów (co może prowadzić do porzucania lęgów)[14].
- Dostępność siedlisk lęgowych może być ograniczona przez nagromadzanie się nieczystości różnego pochodzenia naniesionych przez morze[14]. Zmniejszenie się populacji lęgowej w Sitka Sound prawdopodobnie było spowodowane nanoszeniem na najchętniej wybierane przez ostrygojady plaże dużej ilości kłód, których źródłem była lokalna działalność związana z obróbką drewna[49].
- Formalna ochrona niektórych obszarów nie zapewnia ochrony przed zagrożeniami naturalnymi lub pochodzenia antropogenicznego. Wiele z ważniejszych miejsc gniazdowania ostrygojadów czarnych znajduje się na obszarach chronionych: rezerwatach, lasach oraz parkach narodowych, stanowych lub prowincjonalnych. Nie zapewnia to jednak ochrony przed drapieżnikami, wymywaniem jaj, niepokojeniem przez ludzi oraz zanieczyszczeniem wybrzeża[14].
Przypisy
[edytuj | edytuj kod]- ↑ Haematopus bachmani, [w:] Integrated Taxonomic Information System (ang.).
- ↑ Systematyka i nazwy polskie za: P. Mielczarek & M. Kuziemko: Podrodzina: Haematopodinae Bonaparte, 1838 – ostrygojady (wersja: 2019-10-11). [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2022-07-27].
- ↑ John James Audubon, Ornithological biography, or an account of the habits of the birds of the United States of America, t. 5, 1839, s. 245–246.
- ↑ a b c d e f g h i j k l m n o p q r s t u Andres, B.A. & Falxa, G.A., Black Oystercatcher (Haematopus bachmani), A. Poole (red.): The Birds of North America No.155, Cornell Lab of Ornithology, 1995.
- ↑ F. Gill, D. Donsker, P. Rasmussen (red.): Buttonquail, thick-knees, sheathbills, plovers, oystercatchers, stilts, painted-snipes, jacanas, Plains-wanderer, seedsnipes. IOC World Bird List (v12.1), 1 lutego 2022. [dostęp 2022-07-27].
- ↑ Clements i inni, The eBird/Clements Checklist of Birds of the World: v2021 [online], 2021 [dostęp 2022-06-30].
- ↑ a b HAEMATOPODIDAE - Oystercatchers and Ibisbill (2:13), [w:] Edward C. Dickinson & Les Christidis (red.), Howard and Moore Complete Checklist of the birds of the World, wyd. 4, t. 2, 2014 [dostęp 2022-07-08].
- ↑ HBW and BirdLife International, Handbook of the Birds of the World and BirdLife International digital checklist of the birds of the world. Version 6 [online], grudzień 2021, s. 123 [dostęp 2022-06-28].
- ↑ a b W. Jetz i inni, The global diversity of birds in space and time, „Nature”, 491 (7424), 2012, s. 444–448, DOI: 10.1038/nature11631, ISSN 0028-0836 [dostęp 2022-06-20] [zarchiwizowane z adresu 2021-10-08] (ang.).
- ↑ Senfeld i inni, Taxonomic status of the extinct Canary Islands Oystercatcher Haematopus meadewaldoi, „Ibis”, 162, 2020, s. 1068–1074, DOI: 10.1111/ibi.12778.
- ↑ a b c d J.R. Jehl, Hybridization and Evolution of Oystercatchers on the Pacific Coast of Baja California, „Ornithological Monographs”, 36, 1985, s. 484–504, DOI: 10.2307/40168300, JSTOR: 40168300.
- ↑ a b c d e f g h i j red.: J. del Hoyo, A. Elliott, J. Sargatal, Handbook of the Birds of the World, t. 3. Hoatzin to Auks, Barcelona: Lynx Edicions, 1996, s. 321, ISBN 84-87334-20-2.
- ↑ a b c d M.-A. L'Hyver & E.H. Miller, Geographic and local variation in nesting phenology and clutch size of the black oystercatcher, „Condor”, 93, 1991, s. 892–903.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w David Tessler i inni, A global assessment of the conservation status of the Black Oystercatcher (Haematopus bachmani), „International Wader Studies”, 20, 2014, s. 83–96.
- ↑ a b c d e f g Matthew Johnson i inni, Seasonal Movements, Winter Range use, and Migratory Connectivity of the Black Oystercatcher, „The Condor”, 112 (4), 2010, s. 731–743, DOI: 10.1525/cond.2010.090215.
- ↑ a b c Weinstein i inni, A first population assessment of Black Oystercatcher Haematopus bachmani in California, „Marine Ornithology”, 42, 2014, s. 49–56, DOI: 10.13140/2.1.3697.2163.
- ↑ a b Gill i inni, Colonization, population growth, and nesting success of Black Oystercatchers following a seismic uplift, „The Condor”, 106 (4), 2004, DOI: 10.1650/7539.
- ↑ a b c Hazlitt i inni, Territory structure, parental provisioning, and chick growth in the American Black Oystercatcher Haematopus bachmani, „Ardea”, 90 (2), 2002, s. 219–227.
- ↑ a b c d Bergman i inni, The Black Oystercatcher as a Sentinel Species in the Recovery of the Northern Abalone - Haematopus bachmani: Contemporary Diet of Black Oystercatchers on Haida Gwaii Includes an Endangered Prey Species, „The Condor”, 115 (4), 2013, s. 800–807, DOI: 10.1525/cond.2013.120182.
- ↑ S.H. Morrell i inni, Feeding Ecology of Black Oystercatchers on South Farallon Island, California, „Studies in Avian Biology”, 2, 1979, s. 185–186.
- ↑ a b c d e f g h i Campbell i inni, The Birds of British Columbia, t. 2. Nonpasserines: Diurnal Birds of Prey through Woodpeckers, Victoria, BC: Royal British Columbia Museum, 1990, s. 125–126.
- ↑ B.A. Andres, Shoreline Habitat Use of Black Oystercatchers Breeding in Prince William Sound, Alaska (Uso de Hábitat de Orilla de Playa por Parte de Individuos de Haematopus bachmani, reproduciéndose en Prince William Sound, Alaska), „Journal of Field Ornithology”, 69 (4), 1998, s. 626–634, JSTOR: 4514367.
- ↑ Hipfner i inni, Sea-surface temperature affects breeding density of an avian rocky intertidal predator, the black oystercatcher Haematopus bachmani, „Journal of Experimental Marine Biology and Ecology”, 440, 2013, s. 29–34, DOI: 10.1016/j.jembe.2012.11.007.
- ↑ S.L. Hazlitt & R.W. Butler, Site Fidelity and Reproductive Success of Black Oystercatchers in British Columbia, „Waterbirds: The International Journal of Waterbird Biology”, 24 (2), 2001, s. 203–207.
- ↑ a b c Alaska Center for Conservation Science (ACCS), Black Oystercatcher (Haematopus bachmani) [online], Alaska Species Ranking System, 8 kwietnia 2019 [dostęp 2022-07-14].
- ↑ a b c M.A. Purdy & E.H. Miller, Time budget and parental behavior of breeding American Black Oystercatchers (Haematopus bachmani) in British Columbia, „Canadian Journal of Zoology”, 66 (8), 1988, s. 1742–1751, DOI: 10.1139/z88-252.
- ↑ Migration, movement and monitoring of black oystercatchers [online], The Green Lab [dostęp 2022-07-18].
- ↑ Jennifer L. Parkin, Judith S. Romero & Herrick E. Hanks, Black Oystercatcher (Haematopus bachmani) Reproductive Success California Central Coast, Monterey Bay Region, Monterey Audubon Society, 2020 [dostęp 2022-07-07].
- ↑ a b Paul J. Baicich & Collin J.O. Harrison, Nests, Eggs, and Nestlings of North American Birds, Princeton University Press, 2005, s. 128–129, ISBN 0-691-12295-4.
- ↑ Hipfner i inni, Biology of black oystercatchers breeding on Triangle Island, British Columbia, 2003—2011, „Northwestern Naturalist”, 93 (2), 2012, s. 145–153.
- ↑ S. Groves, Chick growth, sibling rivalry, and chick production in American black oystercatchers, „Auk”, 101 (3), 1984, s. 525–531, DOI: 10.1093/auk/101.3.525.
- ↑ K.H. Morgan, Underwater Swimming Behavior of American Black Oystercatcher Chicks (Nado Bajo el Agua por Parte de Polluelos de Haematopus bachmani), „Journal of Field Ornithology”, 65 (3), 1994, s. 406–409.
- ↑ S.L. Hazlitt & A.J. Gaston, Black Oystercatcher Natal Philopatry in the Queen Charlotte Islands, British Columbia, „The Wilson Bulletin”, 114 (4), 2002, s. 520–522, JSTOR: 4164498.
- ↑ NR Haematopus bachmani [online], BirdLife International [dostęp 2022-06-21].
- ↑ Blackish Oystercatcher Haematopus ater [online], BirdLife International [dostęp 2022-06-21].
- ↑ a b c Timothy D. Meehan i inni, A Population Model Exploring Factors Influencing Black Oystercatcher (Haematopus bachmani) Population Dynamics, „Waterbirds”, 41 (2), 2018, s. 115–221, DOI: 10.1675/063.041.0202.
- ↑ a b c d Jeremy Seth Bennett, Wintering and breeding distributions of Black Oystercatchers (Haematopus bachmani): Long-term trends and the influence of climate [online], Simon Fraser University | Biological Sciences Department, 2018.
- ↑ L. Ware, Satellite telemetry reveals habitat selection decisions by black oystercatchers across seasonal, diel, and tidal cycles [online], Simon Fraser University | Biological Sciences Department, 2021.
- ↑ a b M. Hipfner, Black Oystercatcher, [w:] Davidson, P.J.A., R.J. Cannings, A.R. Couturier, D. Lepage & C.M. Di Corrado (red.): The Atlas of the Breeding Birds of British Columbia, 2008-2012 [online], Bird Studies Canada. Delta, B.C., 2015.
- ↑ B.C. Conservation Data Centre, Species Summary: Haematopus bachmani [online], British Columbia Ministry of Environment, 2006 [dostęp 2022-07-14].
- ↑ a b James E. Lyons i inni, Large-scale monitoring of shorebird populations using count data and N-mixture models: Black Oystercatcher (Haematopus bachmani) surveys by land and sea, „The Auk”, 129 (4), 2012, DOI: 10.1525/auk.2012.11253.
- ↑ Washington Natural Heritage Program List of Animal Species with Ranks October 2017, Washington Department Of Natural Resources, 2017, s. 8 [dostęp 2022-07-26].
- ↑ Joe Liebezeit i inni, Black Oystercatcher (Haematopus bachmani) Population Size, Use of Marine Reserve Complexes, and Spatial Distribution In Oregon, „Northwestern Naturalist”, 101 (1), 2020, s. 14, DOI: 10.1898/1051-1733-101.1.14, ISSN 1051-1733.
- ↑ Jimmy Kagan i inni, Rare, Threatened and Endangered Species of Oregon, Oregon Biodiversity Information Center | Portland State University, 2013, s. 16 [dostęp 2022-07-26].
- ↑ T.A. Gotthardt, G. Hammerson & David Tessler, Haematopus bachmani Black Oystercatcher [online], NatureServe Explorer, 2008 [dostęp 2022-07-24].
- ↑ Tessler i inni, Black Oystercatcher (Haematopus bachmani) Conservation Action Plan. Version 1.1. [online], International Black Oystercatcher Working Group | Alaska Department of Fish and Game, Anchorage, Alaska | U.S. Fish and Wildlife Service, Anchorage, Alaska | Manomet Center for Conservation Sciences, Manomet, Massachusetts, 2010.
- ↑ Black Oystercatcher (Haematopus bachmani) Reproductive Success Monitoring San Luis Obispo County, CA 2020 Final Report [online], Audubon California, 10 maja 2020 [dostęp 2022-07-14].
- ↑ Julie A. Morse, Abby N. Powell, Michael D. Tetreau, Productivity of Black Oystercatchers: Effects of Recreational Disturbance in a National Park, „The Condor”, 108 (3), 2006, s. 623–633, DOI: 10.1093/condor/108.3.623.
- ↑ B.A. Andres & R.E. Christensen, Dramatic changes in the numberof Black Oystercatchers nesting in Sitka Sound, Alaska, „Wader Study Group Bulletin”, 116 (3), 2009, s. 181–184.
Linki zewnętrzne
[edytuj | edytuj kod]- Zdjęcia, nagrania głosów i krótkie filmy. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
