PARK2
Parkin je protein koji je kod ljudi kodiran genom PARK2. To je E3 ubikvitin-ligaza od 465 ostataka koji ima kritičnu ulogu u ubikvitinaciji – procesu kojim su molekule kovalentno povezane sa ubikvitinom (Ub) i usmjerene prema razgradnji u proteasomima ili lizosomima. Ubikvitinacija uključuje uzastopno djelovanje tri enzima. E1 enzim koji aktivira ubikvitin u eukariotskim ćelijama veže se za neaktivni Ub putem tioesterskih veza i mobilizira ga u procesu ovisnom o ATP-u. (2) Ub se zatim prenosi u E2 enzim koji konjuguje ubikvitin prije nego što se konjugira sa ciljnim proteinom preko E3 ubikvitin-ligaza.[5] Postoji mnoštvo E3 ligaza, koje se razlikuju po strukturi i specifičnosti supstrat, kako bi omogućile selektivno ciljanje proteina za unutarćelijsku degradaciju.
Konkretno, parkin prepoznaje proteine na vanjskoj membrani mitohondrija nakon povede ćelija i posreduje u čišćenju oštećenih mitohondrija putem autofagije i proteasomskih mehanizama.[6] Parkin također poboljšava preživljavanje ćelija suzbijanjem mitohondrijski ovisnih i neovisnih apoptoza. Mutacije povezane su s mitohondrijskom disfunkcijom, što dovodi do neuronske smrti u Parkinsonovoj bolesti [7] iporemećenog metabolizma i tumorigenezi.[8]
Aminokiselinska sekvenca
[uredi | uredi izvor]Dužina polipeptidnog lanca je 465 aminokiselina, а molekulska težina 51.641 Da.[9]
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MIVFVRFNSS | HGFPVEVDSD | TSIFQLKEVV | AKRQGVPADQ | LRVIFAGKEL | ||||
| RNDWTVQNCD | LDQQSIVHIV | QRPWRKGQEM | NATGGDDPRN | AAGGCEREPQ | ||||
| SLTRVDLSSS | VLPGDSVGLA | VILHTDSRKD | SPPAGSPAGR | SIYNSFYVYC | ||||
| KGPCQRVQPG | KLRVQCSTCR | QATLTLTQGP | SCWDDVLIPN | RMSGECQSPH | ||||
| CPGTSAEFFF | KCGAHPTSDK | ETSVALHLIA | TNSRNITCIT | CTDVRSPVLV | ||||
| FQCNSRHVIC | LDCFHLYCVT | RLNDRQFVHD | PQLGYSLPCV | AGCPNSLIKE | ||||
| LHHFRILGEE | QYNRYQQYGA | EECVLQMGGV | LCPRPGCGAG | LLPEPDQRKV | ||||
| TCEGGNGLGC | GFAFCRECKE | AYHEGECSAV | FEASGTTTQA | YRVDERAAEQ | ||||
| ARWEAASKET | IKKTTKPCPR | CHVPVEKNGG | CMHMKCPQPQ | CRLEWCWNCG | ||||
| CEWNRVCMGD | HWFDV |
Struktura
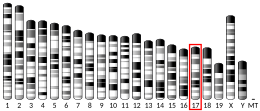
[uredi | uredi izvor]Parkin je protein koji čiji se genski lokus (PARK2) kod ljudi nalazi na hromosomu 6.[10][11] Tačna funkcija ovog proteina nije poznata; međutim, zna se da je komponenta kompleksa multiproteina E3-ubikvitin ligaze koji je pak dio ubikvitin-proteasomskog sistema, koji posreduje u ciljanju proteina za razgradnju . Poznato je da mutacije u ovom genu uzrokuju porodični oblik Parkinsonove bolesti, poznate kao autosomno recesivna maloljetnička Parkinsonova bolest (AR-JP). Štaviše, opisano je da je parkin neophodan za mitofagiju (autofagiju mitohondrija).
Međutim, nije jasno kako gubitak funkcije parkinskog proteina dovodi do smrti dopaminergijskih ćelija) u ovoj bolesti. Prevladavajuća hipoteza je da parkin pomaže u razgradnji jednog ili više proteina toksičnih za dopaminergične neurone. Putativni supstrati parkina uključuju sinfilin-1, CDC-rel1 , ciklin E, p38 tRNK sitazu, Pael-R, sinaptotagmin XI, sp22 i sam parkin (vidi takođe ubikvitin-ligaza). Osim toga, parkin sadrži C-terminalni motiv koji veže PDZ-domene. Pokazalo se da se parkin povezuje na PDZ ovisan način sa domenom PDZ, koji sadrži proteine CASK i PICK1.

B: RING0, RING1, IBR i RING2 svaki koordiniraju dva Zn iona (približna lokacija označena sivim krugovima) za strukturnu stabilnost, što dovodi do stehiometrijske konformacije od 8 Zn2+/parkin.
Kao i drugi članovi porodice R3-RING-RING (RBR) E3 ligaza, parkin posjeduje dva RING-domena prstiju i jedan između RING (IBR) regije. RING1 formira mjesto vezanja za E2 Ub-konjugirajući enzim, dok RING2 sadrži katalitski cisteinski ostatak (Cys431) koji cijepa Ub iz E2 i privremeno ga veže za E3 tioesterskom vezom.[6] Prijenosu Ub pomažu susjedni ostaci histidina His433, koji prihvata proton iz Cys431 da ga aktivira, i glutamat Glu444, koji je uključen u autoubikvitaciju.[12] Zajedno tvore katalitsku trijadu, čije je sklapanje potrebno za aktivaciju parkina.[13] Parkin također sadrži N-terminalni Ub-sličan domen (Ubl) za specifično prepoznavanje podloge, jedinstvenog domen RING0 i represorske (REP) regije koja tonski potiskuje aktivnost ligaza.
U uvjetima mirovanja, čvrsto namotana konformacija parkina čini ga neaktivnim, jer je pristup katalitskom ostatku RING2 sterno blokiran pomoću RING0, dok domen vezanja E2 na RING1 zaklanjaju Ubl i REP.[6] Aktiviranje stimulusa remeti ove međudomenske interakcije i izaziva kolaps parkina duž sučelja RING1-RING0.[13] Aktivno mjesto RING2 je povučeno prema E2-Ub vezanom za RING1, olakšavajući stvaranje međuproizvoda Ub-tioestera. Aktivacija parkina zahtijeva fosforilaciju serina Ser65 u Ubl-u pomoću serin/treonin-kinaza, PINK1. Dodavanje nabijenog fosfata destabilizira hidrofobne interakcije između Ubl i susjednih podregija, smanjujući autoinhibitorne efekte ovog domena N-kraja.[14] Utvrđeno je da misens mutacije Ser65Ala desabliziraju vezivanje Ub-parkina, a istovremeno inhibiraju regrutovanje parkina u oštećene mitohondrije.[15] PINK1 također fosforilira Ub na Ser65, ubrzavajući njegovo otpuštanje iz E2 i povećavajući njegov afinitet za parkin.[14]
Iako su strukturne promjene nakon fosforilacije neizvjesne, kristalizacija parkina otkrila je kationski džep formiran u RING0-u od lizinskih i argininskih ostataka Lys161, Arg163 i Lys211 koji tvore navodno mjesto vezivanja fosfata.[16] S obzirom na to da je domen RING0 jedinstven za parkin i da njegovo hidrofobno sučelje s RING1 zatrpava Cys431 u neaktivnom parkinu,[15] ciljanje fosforiliranog Ub i/ili Ubl prema ovoj veznoj niši moglo bi biti kritično u uklanjanju autoinhibitornih kompleksa tokom aktivacije parkina.
Funkcija
[uredi | uredi izvor]Mitofagija
[uredi | uredi izvor]Parkin ima ključnu ulogu u mitofagiji i čišćenju reaktivnih vrsta kisika.[17] Mitofagija je uklanjanje oštećenih mitohondrija u autofagosomima i ovisi o ciklusu pozitivne povrtne sprege koji uključuje sinergijsko djelovanje parkina i PINK1. Nakon teške ćelijake povrede, zaostajanje mitohondrijskog membranskog potencijala sprječava unos PINK1 u mitohondrijski matriks i uzrokuje njegovo nakupljanje na vanjskoj mitohondrijskoj membrani (OMM).[18] Parkin se regrutira u mitohondrije, nakon depolarizacije i fosforilira PINK1, koji istovremeno fosforilira Ub. prethodno konjugiran na proteine mitohondrijske membrane. Fosforilacija PINK1 i Ub olakšava aktivaciju parkina i daljnje sklapanje mono- i poli-Ub lanaca.[14] S obzirom na blizinu ovih lanaca PINK1, daljnja fosforilacija Ub na Ser65 vjerojatna je, pojačavajući mobilizaciju parkina i supstratnu sveprisutnost u ciklusu samopojačavanja.[6]
Parkinski supstrati uključuju mitofusine Mfn1 i Mfn2, koji su velike GTPaze koji promoviraju fuziju mitohondrija u dinamične, cjevaste komplekse koji povećavaju učinkovitost oksidativne fosforilacije.[19] Međutim, nakon mitohondrijskog oštećenja, nužna je degradacija fuzijskih proteina kako bi se odvojili od mreže putem mitohondrijskih fisija i spriječili kvarenje zdravih mitohondrija.[[20] Parkin je stoga potreban prije mitofagije, jer ubikvitinizira Mfn1/2, označavajući ga za proteasomsku degradaciju. Proteomske studije identificirale su dodatne OMM proteine kao supstrate za parkin, uključujući fisijski protein FIS, njegov adapter TBC1D15 i translokaze TOMM20 i TOMM70, koje olakšavaju kretanje proteina poput PINK1 preko OMM-a.[21] Miro (ili RHOT1/RHOT2) je OMM protein koji je kritičan za aksonsdki transport, a mogu biti sveprisutni i usmjereni prema proteasomskoj degradaciji putem parkina.[22] Kvar miro-a izaziva značajno smanjenje migracije ugroženih mitohondrija duž mišjih aksona u hipokampusnim neuronima,[23] pojačavajući važnost parkina u odvajanju defektnih mitohondrija od njihovih funkcionalnih parnjaka i ograničavajući prostorno širenje mitohondrijske disfunkcije, prije autofagije.
Tokom mitofagije, parkin cilja VDAC1, anionski kanal pod naponom koji prolazi kroz konformacijske promjene. nakon depolarizacije mitohondrijske membrane, izlažući citosolni domen za sveprisutnu primjenu.[18] Utišavanje ekspresija VDAC1 u HeLa ćelijama značajno je smanjilo regrutiranje parkina u depolarizane mitohondrije i njihov naknadni klirens,[24] ističući kritičnu ulogu VDAC1 kao selektivnog markera mitohondrijskog oštećenja i izazivača mitofagije. Nakon konjugacije Ub, parkin regrutira receptore autofagije, kao što su p62, TAX1BP1 i CALCOCO2, olakšavajući sastavljanje autofagosoma koji probavljaju defektne mitohondrije.[21]
Ćelijsko preživljavanje
[uredi | uredi izvor]Aktivacijom signalizacije NF-κB, parkin povećava preživljavanje i štiti ćelije od apoptoze izazvane stresom. Nakon ćelijske povrede, parkin aktivira katalitski HOIP podjedinice druge E3 ligaze LUBAC. HOIP pokreće sklapanje linearnog Ub polimera na NF-κB esencijalnom modulatoru (NEMO), potencirajući transkripciju mitohondrijske GTPaze OPA1.[25] Povećana translacija OPA1 održava strukturu krista i smanjuje oslobađanje citohroma C iz mitohondrija, inhibirajući kaspazom posredovanu apoptozu. ]Ono što je važno, parkin aktivira HOIP sa većom potencijom od ostalih faktora povezanih s LUBAC-om HOIL-1 i oštrinom,[26] što znači da mobilizacija parkina značajno povećava toleranciju na umjerenu stresora.
Parkin ima afinitet vezanja za DNK i proizvode ovisne o dozi, smanjenje transkripcije i aktivnosti proapoptotskog faktora p53. Transfekcija p53 promotora sa skraćenim verzijama parkina u SH-SY5Y neurone otkrila je da se parkin direktno veže za promotor p53, preko svog RING1-domena.[27] Nasupot tome, parkin može biti transkripcijski cilj p53-a u plućnim H460, gdje posreduje tumour-supresorsku aktivnost p53-a.[8] S obzirom na njegovu ulogu u mitohondrijskoj homeostazi, parkin pomaže p53 u održavanju mitohondrijskog disanja, dok ograničava unos glukoze i proizvosnju laktata, sprječavajući tako nastanak Warburgovog učinka tokom tumourigeneze.[28] Parkin dodatno podiže nivo citosolnog glutationa i štiti od oksidativnog stresa, okarakterizirajući ga kao kritičnog supresora tumora sa anti-glikolitskim i antioksidativnim sposobnostima.[8]
Klinički značaj
[uredi | uredi izvor]Pokazano je da su gen PARK2 i parkin vezani za više porfemećaja:
Interakcije
[uredi | uredi izvor]Parkin (ligaza) pokazao je interakcije sa:
Reference
[uredi | uredi izvor]- ^ a b c GRCh38: Ensembl release 89: ENSG00000185345 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000023826 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Pickart CM, Eddins MJ (novembar 2004). "Ubiquitin: structures, functions, mechanisms". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1695 (1–3): 55–72. doi:10.1016/j.bbamcr.2004.09.019. PMID 15571809.
- ^ a b c d Seirafi M, Kozlov G, Gehring K (juni 2015). "Parkin structure and function". The FEBS Journal. 282 (11): 2076–88. doi:10.1111/febs.13249. PMC 4672691. PMID 25712550.
- ^ Dawson TM, Dawson VL (2014). "The role of parkin in familial and sporadic Parkinson's disease". Movement Disorders. 25 (Suppl 1): S32-9. doi:10.1002/mds.22798. PMC 4115293. PMID 20187240.
- ^ a b c Zhang C, Lin M, Wu R, Wang X, Yang B, Levine AJ, Hu W, Feng Z (2011). "Parkin, a p53 target gene, mediates the role of p53 in glucose metabolism and the Warburg effect". Proceedings of the National Academy of Sciences of the United States of America. 108 (39): 16259–64. Bibcode:2011PNAS..10816259Z. doi:10.1073/pnas.1113884108. PMC 3182683. PMID 21930938.
- ^ "UniProt, O60260" (jezik: engleski). Pristupljeno 9. 10. 2021.
- ^ Kitada T, Asakawa S, Hattori N, Matsumine H, Yamamura Y, Minoshima S, Yokochi M, Mizuno Y, Shimizu N (april 1998). "Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism". Nature. 392 (6676): 605–8. Bibcode:1998Natur.392..605K. doi:10.1038/33416. PMID 9560156. S2CID 4432261.
- ^ Matsumine H, Yamamura Y, Hattori N, Kobayashi T, Kitada T, Yoritaka A, Mizuno Y (april 1998). "A microdeletion of D6S305 in a family of autosomal recessive juvenile parkinsonism (PARK2)". Genomics. 49 (1): 143–6. doi:10.1006/geno.1997.5196. PMID 9570960.
- ^ Trempe JF, Sauvé V, Grenier K, Seirafi M, Tang MY, Ménade M, Al-Abdul-Wahid S, Krett J, Wong K, Kozlov G, Nagar B, Fon EA, Gehring K (juni 2013). "Structure of parkin reveals mechanisms for ubiquitin ligase activation". Science. 340 (6139): 1451–5. Bibcode:2013Sci...340.1451T. doi:10.1126/science.1237908. PMID 23661642. S2CID 206548928.
- ^ a b Riley BE, Lougheed JC, Callaway K, Velasquez M, Brecht E, Nguyen L, Shaler T, Walker D, Yang Y, Regnstrom K, Diep L, Zhang Z, Chiou S, Bova M, Artis DR, Yao N, Baker J, Yednock T, Johnston JA (2013). "Structure and function of Parkin E3 ubiquitin ligase reveals aspects of RING and HECT ligases". Nature Communications. 4: 1982. Bibcode:2013NatCo...4.1982R. doi:10.1038/ncomms2982. PMC 3709503. PMID 23770887.
- ^ a b c Koyano F, Okatsu K, Kosako H, Tamura Y, Go E, Kimura M, Kimura Y, Tsuchiya H, Yoshihara H, Hirokawa T, Endo T, Fon EA, Trempe JF, Saeki Y, Tanaka K, Matsuda N (juni 2014). "Ubiquitin is phosphorylated by PINK1 to activate parkin". Nature. 510 (7503): 162–6. Bibcode:2014Natur.510..162K. doi:10.1038/nature13392. PMID 24784582. S2CID 4390259.
- ^ a b Iguchi M, Kujuro Y, Okatsu K, Koyano F, Kosako H, Kimura M, Suzuki N, Uchiyama S, Tanaka K, Matsuda N (juli 2013). "Parkin-catalyzed ubiquitin-ester transfer is triggered by PINK1-dependent phosphorylation". The Journal of Biological Chemistry. 288 (30): 22019–32. doi:10.1074/jbc.M113.467530. PMC 3724655. PMID 23754282.
- ^ Wauer T, Komander D (juli 2013). "Structure of the human Parkin ligase domain in an autoinhibited state". The EMBO Journal. 32 (15): 2099–112. doi:10.1038/emboj.2013.125. PMC 3730226. PMID 23727886.
- ^ Olszewska, Diana Angelika; Lynch, Tim (2015). "Will Crystal Parkin Help in Understanding the Future of Parkinson’s Disease?". Frontiers in Neurology. 6: 35. doi:10.3389/fneur.2015.00035. PMC 4338761. PMID 25759682.
- ^ a b Durcan TM, Fon EA (maj 2015). "The three 'P's of mitophagy: PARKIN, PINK1, and post-translational modifications". Genes & Development. 29 (10): 989–99. doi:10.1101/gad.262758.115. PMC 4441056. PMID 25995186.
- ^ Youle RJ, van der Bliek AM (august 2012). "Mitochondrial fission, fusion, and stress". Science. 337 (6098): 1062–5. Bibcode:2012Sci...337.1062Y. doi:10.1126/science.1219855. PMC 4762028. PMID 22936770.
- ^ Twig G, Elorza A, Molina AJ, Mohamed H, Wikstrom JD, Walzer G, Stiles L, Haigh SE, Katz S, Las G, Alroy J, Wu M, Py BF, Yuan J, Deeney JT, Corkey BE, Shirihai OS (januar 2008). "Fission and selective fusion govern mitochondrial segregation and elimination by autophagy". The EMBO Journal. 27 (2): 433–46. doi:10.1038/sj.emboj.7601963. PMC 2234339. PMID 18200046.
- ^ a b Sarraf SA, Raman M, Guarani-Pereira V, Sowa ME, Huttlin EL, Gygi SP, Harper JW (april 2013). "Landscape of the PARKIN-dependent ubiquitylome in response to mitochondrial depolarization". Nature. 496 (7445): 372–6. Bibcode:2013Natur.496..372S. doi:10.1038/nature12043. PMC 3641819. PMID 23503661.
- ^ Narendra D, Walker JE, Youle R (novembar 2012). "Mitochondrial quality control mediated by PINK1 and Parkin: links to parkinsonism". Cold Spring Harbor Perspectives in Biology. 4 (11): a011338. doi:10.1101/cshperspect.a011338. PMC 3536340. PMID 23125018.
- ^ Shlevkov E, Kramer T, Schapansky J, LaVoie MJ, Schwarz TL (oktobar 2016). "Miro phosphorylation sites regulate Parkin recruitment and mitochondrial motility". Proceedings of the National Academy of Sciences of the United States of America. 113 (41): E6097–E6106. doi:10.1073/pnas.1612283113. PMC 5068282. PMID 27679849.
- ^ Geisler S, Holmström KM, Skujat D, Fiesel FC, Rothfuss OC, Kahle PJ, Springer W (februar 2010). "PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1". Nature Cell Biology. 12 (2): 119–31. doi:10.1038/ncb2012. PMID 20098416. S2CID 26096413.
- ^ Aleksaniants GD (2013). "[Use of balneo-, peloid- and centimeter-wave therapy in the complex treatment of patients with circumscribed scleroderma]". Vestnik Dermatologii I Venerologii. 32 (6): 58–60. doi:10.1038/emboj.2013.70. PMC 3630365. PMID 23531882.
- ^ Müller-Rischart AK, Pilsl A, Beaudette P, Patra M, Hadian K, Funke M, Peis R, Deinlein A, Schweimer C, Kuhn PH, Lichtenthaler SF, Motori E, Hrelia S, Wurst W, Trümbach D, Langer T, Krappmann D, Dittmar G, Tatzelt J, Winklhofer KF (mart 2013). "The E3 ligase parkin maintains mitochondrial integrity by increasing linear ubiquitination of NEMO". Molecular Cell. 49 (5): 908–21. doi:10.1016/j.molcel.2013.01.036. PMID 23453807.
- ^ da Costa CA, Sunyach C, Giaime E, West A, Corti O, Brice A, Safe S, Abou-Sleiman PM, Wood NW, Takahashi H, Goldberg MS, Shen J, Checler F (novembar 2009). "Transcriptional repression of p53 by parkin and impairment by mutations associated with autosomal recessive juvenile Parkinson's disease". Nature Cell Biology. 11 (11): 1370–5. doi:10.1038/ncb1981. PMC 2952934. PMID 19801972.
- ^ Matoba S, Kang JG, Patino WD, Wragg A, Boehm M, Gavrilova O, Hurley PJ, Bunz F, Hwang PM (juni 2006). "p53 regulates mitochondrial respiration". Science. 312 (5780): 1650–3. Bibcode:2006Sci...312.1650M. doi:10.1126/science.1126863. PMID 16728594. S2CID 36668814.
- ^ *602544
- ^ Veeriah S, Taylor BS, Meng S, Fang F, Yilmaz E, Vivanco I, Janakiraman M, Schultz N, Hanrahan AJ, Pao W, Ladanyi M, Sander C, Heguy A, Holland EC, Paty PB, Mischel PS, Liau L, Cloughesy TF, Mellinghoff IK, Solit DB, Chan TA (januar 2010). "Somatic mutations of the Parkinson's disease-associated gene PARK2 in glioblastoma and other human malignancies". Nature Genetics. 42 (1): 77–82. doi:10.1038/ng.491. PMC 4002225. PMID 19946270.
- ^ Choi P, Golts N, Snyder H, Chong M, Petrucelli L, Hardy J, Sparkman D, Cochran E, Lee JM, Wolozin B (septembar 2001). "Co-association of parkin and alpha-synuclein". NeuroReport. 12 (13): 2839–43. doi:10.1097/00001756-200109170-00017. PMID 11588587. S2CID 83941655.
- ^ a b Kawahara K, Hashimoto M, Bar-On P, Ho GJ, Crews L, Mizuno H, Rockenstein E, Imam SZ, Masliah E (mart 2008). "alpha-Synuclein aggregates interfere with Parkin solubility and distribution: role in the pathogenesis of Parkinson disease". The Journal of Biological Chemistry. 283 (11): 6979–87. doi:10.1074/jbc.M710418200. PMID 18195004.
- ^ Fallon L, Moreau F, Croft BG, Labib N, Gu WJ, Fon EA (januar 2002). "Parkin and CASK/LIN-2 associate via a PDZ-mediated interaction and are co-localized in lipid rafts and postsynaptic densities in brain". The Journal of Biological Chemistry. 277 (1): 486–91. doi:10.1074/jbc.M109806200. PMID 11679592.
- ^ a b Staropoli JF, McDermott C, Martinat C, Schulman B, Demireva E, Abeliovich A (mart 2003). "Parkin is a component of an SCF-like ubiquitin ligase complex and protects postmitotic neurons from kainate excitotoxicity". Neuron. 37 (5): 735–49. doi:10.1016/s0896-6273(03)00084-9. PMID 12628165. S2CID 17024826.
- ^ a b c d Imai Y, Soda M, Hatakeyama S, Akagi T, Hashikawa T, Nakayama KI, Takahashi R (juli 2002). "CHIP is associated with Parkin, a gene responsible for familial Parkinson's disease, and enhances its ubiquitin ligase activity". Molecular Cell. 10 (1): 55–67. doi:10.1016/s1097-2765(02)00583-x. PMID 12150907.
- ^ Imai Y, Soda M, Inoue H, Hattori N, Mizuno Y, Takahashi R (juni 2001). "An unfolded putative transmembrane polypeptide, which can lead to endoplasmic reticulum stress, is a substrate of Parkin". Cell. 105 (7): 891–902. doi:10.1016/s0092-8674(01)00407-x. PMID 11439185. S2CID 721363.
- ^ Corti O, Hampe C, Koutnikova H, Darios F, Jacquier S, Prigent A, Robinson JC, Pradier L, Ruberg M, Mirande M, Hirsch E, Rooney T, Fournier A, Brice A (juni 2003). "The p38 subunit of the aminoacyl-tRNA synthetase complex is a Parkin substrate: linking protein biosynthesis and neurodegeneration". Human Molecular Genetics. 12 (12): 1427–37. doi:10.1093/hmg/ddg159. PMID 12783850.
- ^ Fukae J, Sato S, Shiba K, Sato K, Mori H, Sharp PA, Mizuno Y, Hattori N (februar 2009). "Programmed cell death-2 isoform1 is ubiquitinated by parkin and increased in the substantia nigra of patients with autosomal recessive Parkinson's disease". FEBS Letters. 583 (3): 521–5. doi:10.1016/j.febslet.2008.12.055. hdl:1721.1/96274. PMID 19146857. S2CID 7121769.
- ^ Choi P, Snyder H, Petrucelli L, Theisler C, Chong M, Zhang Y, Lim K, Chung KK, Kehoe K, D'Adamio L, Lee JM, Cochran E, Bowser R, Dawson TM, Wolozin B (oktobar 2003). "SEPT5_v2 is a parkin-binding protein". Brain Research. Molecular Brain Research. 117 (2): 179–89. doi:10.1016/s0169-328x(03)00318-8. PMID 14559152.
- ^ Liu M, Aneja R, Sun X, Xie S, Wang H, Wu X, Dong JT, Li M, Joshi HC, Zhou J (decembar 2008). "Parkin regulates Eg5 expression by Hsp70 ubiquitination-dependent inactivation of c-Jun NH2-terminal kinase". The Journal of Biological Chemistry. 283 (51): 35783–8. doi:10.1074/jbc.M806860200. PMID 18845538.
- ^ Huynh DP, Scoles DR, Nguyen D, Pulst SM (oktobar 2003). "The autosomal recessive juvenile Parkinson disease gene product, parkin, interacts with and ubiquitinates synaptotagmin XI". Human Molecular Genetics. 12 (20): 2587–97. doi:10.1093/hmg/ddg269. PMID 12925569.
- ^ Yu F, Zhou J (juli 2008). "Parkin is ubiquitinated by Nrdp1 and abrogates Nrdp1-induced oxidative stress". Neuroscience Letters. 440 (1): 4–8. doi:10.1016/j.neulet.2008.05.052. PMID 18541373. S2CID 2169911.
Dopunska literatura
[uredi | uredi izvor]- Saito M, Matsumine H, Tanaka H, Ishikawa A, Matsubayashi S, Hattori Y, Mizuno Y, Tsuji S (januar 1997). "[Clinical characteristics and linkage analysis of autosomal recessive form of juvenile parkinsonism(AR-JP)]". Nihon Rinsho. Japanese Journal of Clinical Medicine. 55 (1): 83–8. PMID 9014427.
- Fishman PS, Oyler GA (juli 2002). "Significance of the parkin gene and protein in understanding Parkinson's disease". Current Neurology and Neuroscience Reports. 2 (4): 296–302. doi:10.1007/s11910-002-0004-7. PMID 12044248. S2CID 21068281.
- Takahashi R (juni 2002). "[Function of Parkin]". Seikagaku. The Journal of Japanese Biochemical Society. 74 (6): 471–6. PMID 12138708.
- West AB, Maidment NT (mart 2004). "Genetics of parkin-linked disease". Human Genetics. 114 (4): 327–36. doi:10.1007/s00439-003-1074-6. PMID 14727181. S2CID 23264061.
- Mata IF, Lockhart PJ, Farrer MJ (april 2004). "Parkin genetics: one model for Parkinson's disease". Human Molecular Genetics. 13 Spec No 1 (90001): R127-33. doi:10.1093/hmg/ddh089. PMID 14976155.
- Baptista MJ, Cookson MR, Miller DW (februar 2004). "Parkin and alpha-synuclein: opponent actions in the pathogenesis of Parkinson's disease". The Neuroscientist. 10 (1): 63–72. doi:10.1177/1073858403260392. PMID 14987449. S2CID 84671340.
- Kahle PJ, Haass C (juli 2004). "How does parkin ligate ubiquitin to Parkinson's disease?". EMBO Reports. 5 (7): 681–5. doi:10.1038/sj.embor.7400188. PMC 1299099. PMID 15229644.
- Pankratz N, Foroud T (april 2004). "Genetics of Parkinson disease". NeuroRx. 1 (2): 235–42. doi:10.1602/neurorx.1.2.235. PMC 534935. PMID 15717024.
- Suzuki H (septembar 2006). "Protein-protein interactions in the mammalian brain". The Journal of Physiology. 575 (Pt 2): 373–7. doi:10.1113/jphysiol.2006.115717. PMC 1819454. PMID 16840513.
- Hattori N, Machida Y, Sato S, Noda K, Iijima-Kitami M, Kubo S, Mizuno Y (2006). "Molecular mechanisms of nigral neurodegeneration in Park2 and regulation of parkin protein by other proteins". Journal of Neural Transmission. Supplementum. Journal of Neural Transmission. Supplementa. 70 (70): 205–8. doi:10.1007/978-3-211-45295-0_31. ISBN 978-3-211-28927-3. PMID 17017530.
- Matsumine H, Saito M, Shimoda-Matsubayashi S, Tanaka H, Ishikawa A, Nakagawa-Hattori Y, Yokochi M, Kobayashi T, Igarashi S, Takano H, Sanpei K, Koike R, Mori H, Kondo T, Mizutani Y, Schäffer AA, Yamamura Y, Nakamura S, Kuzuhara S, Tsuji S, Mizuno Y (mart 1997). "Localization of a gene for an autosomal recessive form of juvenile Parkinsonism to chromosome 6q25.2-27". American Journal of Human Genetics. 60 (3): 588–96. PMC 1712507. PMID 9042918.
- Kitada T, Asakawa S, Hattori N, Matsumine H, Yamamura Y, Minoshima S, Yokochi M, Mizuno Y, Shimizu N (april 1998). "Mutations in the parkin gene cause autosomal recessive juvenile parkinsonism". Nature. 392 (6676): 605–8. Bibcode:1998Natur.392..605K. doi:10.1038/33416. PMID 9560156. S2CID 4432261.
- Matsumine H, Yamamura Y, Hattori N, Kobayashi T, Kitada T, Yoritaka A, Mizuno Y (april 1998). "A microdeletion of D6S305 in a family of autosomal recessive juvenile parkinsonism (PARK2)". Genomics. 49 (1): 143–6. doi:10.1006/geno.1997.5196. PMID 9570960.
- Tassin J, Dürr A, de Broucker T, Abbas N, Bonifati V, De Michele G, Bonnet AM, Broussolle E, Pollak P, Vidailhet M, De Mari M, Marconi R, Medjbeur S, Filla A, Meco G, Agid Y, Brice A (juli 1998). "Chromosome 6-linked autosomal recessive early-onset Parkinsonism: linkage in European and Algerian families, extension of the clinical spectrum, and evidence of a small homozygous deletion in one family. The French Parkinson's Disease Genetics Study Group, and the European Consortium on Genetic Susceptibility in Parkinson's Disease". American Journal of Human Genetics. 63 (1): 88–94. doi:10.1086/301934. PMC 1377254. PMID 9634531.
- Hattori N, Matsumine H, Asakawa S, Kitada T, Yoshino H, Elibol B, Brookes AJ, Yamamura Y, Kobayashi T, Wang M, Yoritaka A, Minoshima S, Shimizu N, Mizuno Y (august 1998). "Point mutations (Thr240Arg and Gln311Stop) [correction of Thr240Arg and Ala311Stop] in the Parkin gene". Biochemical and Biophysical Research Communications. 249 (3): 754–8. doi:10.1006/bbrc.1998.9134. PMID 9731209.
- Lücking CB, Abbas N, Dürr A, Bonifati V, Bonnet AM, de Broucker T, De Michele G, Wood NW, Agid Y, Brice A (oktobar 1998). "Homozygous deletions in parkin gene in European and North African families with autosomal recessive juvenile parkinsonism. The European Consortium on Genetic Susceptibility in Parkinson's Disease and the French Parkinson's Disease Genetics Study Group". Lancet. 352 (9137): 1355–6. doi:10.1016/S0140-6736(05)60746-5. PMID 9802278. S2CID 44409075.
- Abbas N, Lücking CB, Ricard S, Dürr A, Bonifati V, De Michele G, Bouley S, Vaughan JR, Gasser T, Marconi R, Broussolle E, Brefel-Courbon C, Harhangi BS, Oostra BA, Fabrizio E, Böhme GA, Pradier L, Wood NW, Filla A, Meco G, Denefle P, Agid Y, Brice A (april 1999). "A wide variety of mutations in the parkin gene are responsible for autosomal recessive parkinsonism in Europe. French Parkinson's Disease Genetics Study Group and the European Consortium on Genetic Susceptibility in Parkinson's Disease". Human Molecular Genetics. 8 (4): 567–74. doi:10.1093/hmg/8.4.567. PMID 10072423.
- Sunada Y, Saito F, Matsumura K, Shimizu T (oktobar 1998). "Differential expression of the parkin gene in the human brain and peripheral leukocytes". Neuroscience Letters. 254 (3): 180–2. doi:10.1016/S0304-3940(98)00697-1. PMID 10214987. S2CID 32794960.
- Shimura H, Hattori N, Kubo S, Yoshikawa M, Kitada T, Matsumine H, Asakawa S, Minoshima S, Yamamura Y, Shimizu N, Mizuno Y (maj 1999). "Immunohistochemical and subcellular localization of Parkin protein: absence of protein in autosomal recessive juvenile parkinsonism patients". Annals of Neurology. 45 (5): 668–72. doi:10.1002/1531-8249(199905)45:5<668::AID-ANA19>3.0.CO;2-Z. PMID 10319893.
Vanjski linkovi
[uredi | uredi izvor]- GeneReviews/NCBI/NIH/UW entry on Parkin Type of Juvenile Parkinson Disease
- parkin protein na US National Library of Medicine Medical Subject Headings (MeSH)