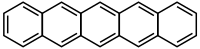
Pentacene
| Pentacene | |
|---|---|
 | |
| Nome IUPAC | |
| Pentacene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C22H14 |
| Massa molecolare (u) | 278,3 |
| Aspetto | solido blu scuro[1] |
| Numero CAS | |
| Numero EINECS | 205-193-7 |
| PubChem | 8671 |
| SMILES | C1=CC=C2C=C3C=C4C=C5C=CC=CC5=CC4=CC3=CC2=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,30[2] |
| Solubilità in acqua | insolubile[1] |
| Temperatura di fusione | 271 °C (544 K)[1] |
| Indicazioni di sicurezza | |
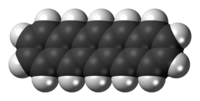
Il pentacene è un composto organico con formula C22H14. Appartiene alla classe degli aceni ed è costituito da cinque anelli benzenici condensati in linea. In condizioni normali forma cristalli blu scuro molto sensibili all'ossidazione. Analogamente agli omologhi superiori esacene ed eptacene, il pentacene è insolubile in acqua e scarsamente solubile in solventi organici.[1]
Sintesi
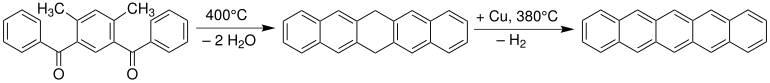
[modifica | modifica wikitesto]Il pentacene fu sintetizzato per la prima volta nel 1912 da William Hobson Mills e Mildred May Gostling.[3] Un metodo classico per la sintesi del pentacene è la reazione di Elbs:[4][5]
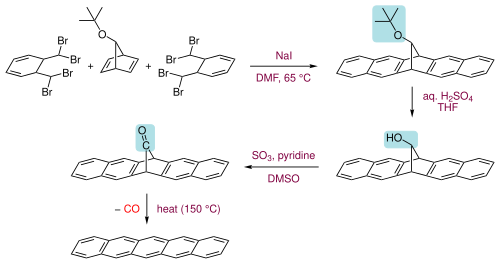
Il pentacene si può ottenere anche da un opportuno precursore allontanando tramite riscaldamento a 150 ºC un piccolo componente volatile come il monossido di carbonio (vedi ultimo passaggio della figura seguente).[6] Il chetone precursore può essere ottenuto in tre passaggi. Da α,α,α',α'-tetrabromo-o-xylene e 7-tert-butossibiciclo[2.2.1]epta-2,5-diene trattati con ioduro di sodio e dimetilformammide si forma il primo composto a cinque anelli. Il gruppo tert-butossi è quindi idrolizzato ad alcool, e successivamente ossidato a chetone.[6] Il pentacene è solubile a caldo in benzeni clorurati come il 1,2,4-triclorobenzene, dal quale può essere ricristallizzato.
Struttura
[modifica | modifica wikitesto]

Allo stato solido il composto cristallizza nel sistema triclino, gruppo spaziale P1, con costanti di reticolo a = 793 pm, b = 614 pm, c = 1603 pm, α = 101,9°, β = 112,6°, γ = 85,8°, con due molecole per cella elementare. Nel cristallo le molecole di pentacene risultano perfettamente planari.[2]
Nell'agosto 2009 un gruppo di ricercatori dell'IBM ha pubblicato l'immagine di una singola molecola di pentacene, ottenuta con un microscopio a forza atomica.[8][9] Nel 2011 tramite un microscopio a effetto tunnel si è osservata la forma degli orbitali di frontiera HOMO e LUMO.[10][11]
Applicazioni
[modifica | modifica wikitesto]Il pentacene è usato come semiconduttore nell'elettronica organica[12] ed è ad esempio utilizzato in transistor OTFT. A tale scopo viene evaporato termicamente o steso tramite spin coating. Il pentacene è quasi insolubile in molti comuni solventi, e quindi vengono in genere utilizzati derivati del pentacene con maggiore solubilità.[13][14][15]
Tossicità / Indicazioni di sicurezza
[modifica | modifica wikitesto]Il composto è disponibile in commercio. Non è classificato come pericoloso secondo il regolamento (CE) 1272/2008. Non risultano rischi di cancerogenicità.[16]
Note
[modifica | modifica wikitesto]- ^ a b c d Jahn 2018
- ^ a b Campbell et al. 1961
- ^ Mills e Mills 1912
- ^ Elbs 1886
- ^ Breitmaier e Jung 2005
- ^ a b Chen et al. 2007
- ^ Dinca et al. 2015
- ^ Palmer 2009
- ^ Gross et al. 2009
- ^ Krieger 2011
- ^ Gross et al. 2011
- ^ Klauk 2006
- ^ Anthony 2006
- ^ Anthony 2008
- ^ Allard et al. 2008
- ^ Sigma-Aldrich 2017
Bibliografia
[modifica | modifica wikitesto]- (EN) S. Allard, M. Forster, B. Souharce, H. Thiem e U. Scherf, Organic Semiconductors for Solution-Processable Field-Effect Transistors (OFETs), in Angew. Chem. Int. Ed., vol. 47, n. 22, 2008, pp. 4070-4098, DOI:10.1002/anie.200701920.
- (EN) J. E. Anthony, Functionalized Acenes and Heteroacenes for Organic Electronics., in Chem. Rev., vol. 106, n. 12, 2006, pp. 5028-5048, DOI:10.1021/cr050966z.
- (EN) J. E. Anthony, The Larger Acenes: Versatile Organic Semiconductors, in Angew. Chem. Int. Ed., vol. 47, n. 3, 2008, pp. 452-483, DOI:10.1002/anie.200604045.
- (DE) E. Breitmaier e G. Jung, 12.5.3 Elbs-Reaktion, in Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen, Stuttgart, Georg Thieme Verlag, 2005, ISBN 9783135415055.
- (EN) R. B. Campbell, J. M. Robertson e J. Trotter, The crystal and molecular structure of pentacene, in Acta Cryst., vol. 14, 1961, pp. 705-711, DOI:10.1107/S0365110X61002163.
- (EN) K.-Y. Chen, H.-H. Hsieh, C.-C. Wu, J.-J. Hwang e T. J. Chow, A new type of soluble pentacene precursor for organic thin-film transistors, in Chem. Commun., vol. 2007, n. 10, 2007, pp. 1065-1067, DOI:10.1039/B616511G.
- (EN) L. E. Dinca, F. De Marchi, J. M. MacLeod, J. Lipton-Duffin e altri, Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene, in Nanoscale, vol. 7, 2015, pp. 3263-3269, DOI:10.1039/C4NR07057G.
- (DE) K. Elbs, Beiträge zur Kenntniss aromatischer Ketone, in J. Prakt. Chem., vol. 33, n. 1, 1886, pp. 180-188, DOI:10.1002/prac.18860330119.
- (EN) L. Gross, F. Mohn, N. Moll, P. Liljeroth e G. Meyer, The Chemical Structure of a Molecule Resolved by Atomic Force Microscopy, in Science, vol. 325, n. 5944, 2009, pp. 1110-1114, DOI:10.1126/science.1176210.
- (EN) L. Gross, N. Moll, F. Mohn, A. Curioni e altri, High-Resolution Molecular Orbital Imaging Using a p-Wave STM Tip, in Phys. Rev. Lett., vol. 107, n. 8, 2011, p. 086101, DOI:10.1103/PhysRevLett.107.086101.
- U. Jahn, Pentacen, su Römpp online, Georg Thieme, 2018. URL consultato il 17 maggio 2018.
- (EN) H. Klauk (a cura di), Organic Electronics: Materials, Manufacturing and Applications, Weinheim, Wiley-VCH, 2006, ISBN 3-527-31264-1.
- K. Krieger, Molecules Imaged Most Intimately, su Science News, American Association for the Advancement of Science, 2011. URL consultato il 18 maggio 2018.
- (EN) W. H. Mills e M. Mills, CCXXX.—The synthetical production of derivatives of dinaphthanthracene, in J. Chem. Soc., Trans., vol. 101, 1912, pp. 2194-2208, DOI:10.1039/CT9120102194.
- J. Palmer, Single molecule's stunning image, su BBC News, 2009. URL consultato il 18 maggio 2018.
- Sigma-Aldrich, Scheda di dati di sicurezza del pentacene, su sigmaaldrich.com, 2017.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su pentacene
Wikimedia Commons contiene immagini o altri file su pentacene