Phản ứng Diels-Alder
Phản ứng Diels-Alder (phản ứng Đinxơ-Anđơ) là phản ứng hóa học trong hóa học hữu cơ, trong đó một anken (dienophile) phản ứng với diene hệ liên hợp, tạo thành dẫn xuất cyclohexene. Otto Diels và Kurt Alder được trao giải thưởng Nobel về hóa học năm 1950 vì xây dựng thành công phản ứng này [1][2][3][4].
.
Phản ứng cộng vòng
[sửa | sửa mã nguồn]Phản ứng Diels-Alder là trường hợp đặc biệt của loại phản ứng tổng quát hơn: phản ứng cộng vòng giữa các hệ π. Trong phản ứng Diels-Alder, 4 electron π của hệ diene liên hợp phản ứng với liên kết đôi của anken chứa 2 electron π. Tên của phản ứng này là phản ứng cộng đóng vòng [4 + 2][5] (cycloaddition [4 + 2])Việc thực hiện các phản ứng này đòi hỏi phần lớn cần cung cấp nhiệt.
Quy tắc Alder
[sửa | sửa mã nguồn]Sự dễ dàng của phản ứng Diels-Alder phụ thuộc mạnh vào bản chất các nhóm thế của diene và dienophil. Phản ứng nguyên mẫu dưới đây, giữa eten và buta-1,3-dien, rất khó và cho năng suất tạo cyclohexen tương đối thấp.

Quy tắc Alder: phản ứng dễ dàng thực hiện hơn giữa diene giàu electron và dienophil nghèo electron. Nói cách khác, một diene "tốt" là được gắn thêm các nguyên tử hoặc nhóm nguyên tử đẩy electron vào hệ liên hợp, một dienophile "tốt" là được gắn thêm các nguyên tử hoặc nhóm nguyên tử hút electron từ nối đôi.
Sự hút và đẩy election của các nhóm thế phụ thuộc vào các hiệu ứng của phản ứng (hiệu ứng cảm ứng, liên hợp, siêu liên hợp). Dưới đây, phản ứng giữa 2,3-dimetylbuta-1,3-dien (có 2 nhóm methyl đẩy electron vào hệ diene liên hợp) và propenal (nhóm aldehyd hút electron khỏi nối đôi) được thực hiện với hiệu suất cao.
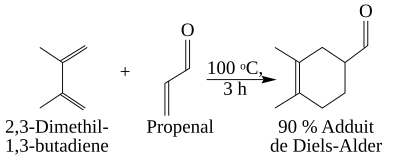
Các ankin được mà nguyên tử cacbon gắn với các nhóm thế hút electron sẽ trở thành dienophil "tốt" và là đối tượng phản ứng Diels - Alder. Thật vậy, phản ứng giữa etin được gắn các nhóm thế hút electron (ví dụ (CH3OOC)-C≡C-(COOCH3)) với buta-1,3-diene là có thể xảy ra.
Hóa học lập thể của phản ứng
[sửa | sửa mã nguồn]Phản ứng mở rộng vòng [4+2] này nằm dưới sự kiểm soát lập thể, dẫn đến sự hình thành một đồng phân endo. Sự chọn lọc này thường được chứng minh bằng tính bền của sản phẩm dạng đồng phân endo
Phản ứng có thể đảo ngược. Các hợp chất exo thường ổn định nhất về mặt nhiệt động lực học. Nếu phản ứng được thực hiện trong một thời gian rất dài, thì trạng thái cân bằng sẽ có lợi cho sản phẩm exo.
Phản ứng ngược
[sửa | sửa mã nguồn]Phản ứng ngược, hay retro-Diels-Alder, được sử dụng để điều chế các hợp chất. Ví dụ, cracking cyclohexene sẽ cho butadien và eten.
Thực tiễn
[sửa | sửa mã nguồn]Phản ứng Diels-Alder gây ra nhiều vấn đề, cyclopentadiene là một ví dụ. Trong quá trình điều chế cyclopentadiene, thao tác làm giảm nhiệt độ đến nhiệt độ phòng sẽ hình thành hợp chất ba vòng. Hợp chất thu được, ổn định ở nhiệt độ phòng (Teb=140°C), phải được chưng cất từ từ để thu hồi cyclopentadiene (Teb=41°C) nhờ phản ứng retro-Diels-Alder.
Ghi chú và tài liệu tham khảo
[sửa | sửa mã nguồn]- ^ Diels, O.; Alder, K. (1928). “Synthesen in der hydroaromatischen Reihe. I. Mitteilung: Anlagerungen von Di-en kohlenwasserstoffen”. Liebigs Ann. Chem (bằng tiếng Đức). 460 (1): 98–122. doi:10.1002/jlac.19284600106. ISSN 0075-4617.
- ^ Diels, O.; Alder, K. (1929). “Synthesen in der hydroaromatischen Reihe. III. Mitteilung: Synthese von Terpenen, Camphern, hydroaromatischen und heterocyclischen Systemen”. Liebigs Ann. Chem (bằng tiếng Đức). 470 (1): 62–103. doi:10.1002/jlac.19294700106. ISSN 0075-4617.
- ^ Diels, O.; Alder, K. (1929). “Synthesen in der hydroaromatischen Reihe. IV. Mitteilung: Über die Anlagerung von Maleinsäure-anhydrid an arylierte Diene, Triene und Fulvene”. Ber. Dtsch. Chem. Ges. (bằng tiếng Đức). 62 (8): 2081–2087. doi:10.1002/cber.19290620829. ISSN 0365-947X.
- ^ Diels, O.; Alder, K. (1929). “Synthesen in der hydroaromatischen Reihe. V. Mitteilung: Über Δ4-Tetrahydro-o-phthalsäure”. Ber. Dtsch. Chem. Ges. (bằng tiếng Đức). 62 (8): 2087–2090. doi:10.1002/cber.19290620830. ISSN 0365-947X.
- ^ “cycloaddition” (PDF).
