Pineen
| Pineen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
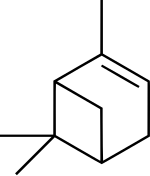
| ||||
α-pineen
| ||||
| Algemeen | ||||
| Molecuulformule | C10H16 | |||
| IUPAC-naam | (1S,5S)-2,6,6-trimethylbicyclo[3.1.1]hept-2-ene (1S,5S)-6,6-dimethyl- | |||
| Molmassa | 136,24 g/mol | |||
| CAS-nummer | 80-56-8 | |||
| Wikidata | Q2095629 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Dichtheid | 0,86 g/cm³ | |||
| Smeltpunt | −62 – −55 °C | |||
| Kookpunt | 155 – 156 °C | |||
| Oplosbaarheid in water | praktisch onoplosbaar in water g/L | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Pineen (C10H16) is een organische verbinding. Het is een monoterpeen, dat uit twee ringen bestaat.[1] Er zijn twee natuurlijke isomeren bekend van pineen: α-pineen en β-pineen. Het zijn twee belangrijke bestanddelen van dennenharsen. Ze komen ook voor in de harsen van vele andere planten, zowel coniferen als niet-conifere planten. Een voorbeeld van deze laatste groep is Artemisia tridentata. Beide isomeren worden door vele insecten gebruikt bij hun chemische communicatie. Pinenen zijn de belangrijkste bestanddelen van terpentijn.
Otto Wallach is verantwoordelijk voor de naamgeving van terpeen en pineen. Hij was de eerste die een systematische studie deed naar pineen.
Planten
[bewerken | brontekst bewerken]Alfa-pineen is in de natuur de meest voorkomende terpenoïde.[2] en is sterk insectafstotend.[3]
Alfa-pineen komt voor in coniferenen in vele andere planten.[4] Pineen is het belangrijkste bestanddeel in de etherische olie van Sideritis spp..[5] en Salvia spp..[6] Cannabis bevat ook alfa-pineen.[4] Hars van de terpentijnboom (Pistacia terebinthus) is rijk aan pineen. Ook pijnboompitten bevatten pineen.[4]
Gebruik
[bewerken | brontekst bewerken]In de chemische industrie geeft selectieve oxidatie van pineen met bepaalde katalysatoren vele grondstoffen voor de parfumindustrie, zoals kunstmatige geurstoffen. Een belangrijk oxidatieproduct is verbenon, samen met de pineen-oxiden, verbenol en verbenylhydroperoxide. [7]

Isomeren
[bewerken | brontekst bewerken] |
 |
 |
 | |
 |
 | |||
 |
 | |||
Biosynthese
[bewerken | brontekst bewerken]α-pineen en β-pineen worden beide gesynthetiseerd uit geranylpyrofosfaat, door ringvorming van linaloylpyrofosfaat gevolgd door het verlies van een proton van de koolstofequivalent.

- ↑ (en) J. Mann, R. S. Davidson, J. B. Hobbs, D. V. Banthorpe, J. B. Harborne, Natural Products, pp309–311, Addison Wesley Longman Ltd., Harlow, UK, 1994. ISBN 0-582-06009-5.
- ↑ (en) Noma Y, Asakawa Y (2010). Biotransformation of monoterpenoids by microorganisms, insects, and mammals. In: Baser KHC, Buchbauer G (eds). Handbook of Essential Oils: Science, Technology, and Applications. CRC Press: Boca Raton, FL, pp. 585–736.
- ↑ (en) (2010). Repellent activity of essential oils: a review. Bioresour Technol 101 (1): 372–378. PMID 19729299. DOI: 10.1016/j.biortech.2009.07.048.
- ↑ a b c (en) Russo, E. B (2011). Taming THC: potential cannabis synergy and phytocannabinoid-terpenoid entourage effects. British Journal of Pharmacology 163 (7): 1344–1364. PMID 21749363. PMC 3165946. DOI: 10.1111/j.1476-5381.2011.01238.x.
- ↑ Kose EO, Deniz IG, Sarikurkcu C, Aktas O, Yavuz M (2010). Chemical composition, antimicrobial and antioxidant activities of the essential oils of Sideritis erythrantha Boiss. and Heldr. (var. erythrantha and var. cedretorum P.H. Davis) endemic in Turkey. Food Chem Toxicol 48: 2960–2965.
- ↑ Ozek G, Demirci F, Ozek T, Tabanca N, Wedge DE, Khan SI et al. (2010). Gas chromatographic-mass spectrometric analysis of volatiles obtained by four different techniques from Salvia rosifolia Sm., and evaluation for biological activity. J Chromatog 1217: 741–748.
- ↑ U. Neuenschwander, Mechanism of the Aerobic Oxidation of α-Pinene , ChemSusChem, Band=3, Nummer=1, 2010, 75–84, DOI=10.1002/cssc.200900228
