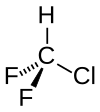
Chlordifluormethan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chlordifluormethan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | CHClF2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, unbrennbares Gas[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,47 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
3,93 kg·m−3 (0 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−40,9 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (3 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Treibhauspotential |
2106 (bezogen auf 100 Jahre)[4] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−482,6 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Chlordifluormethan ist eine chemische Verbindung die zur Gruppe der teilhalogenierten Kohlenwasserstoffe H-FCKW gehört und auch als R-22 bezeichnet wird.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Chlordifluormethan wird in flüssiger Phase aus Tetrachlormethan oder aus Chloroform CHCl3 durch partielle Fluorierung mithilfe von Antimon(V)-chloridfluorid (SbCl4F) als Katalysator hergestellt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chlordifluormethan ist ein farbloses Gas, das bei Normaldruck bei −40,9 °C siedet.[2] Die molare Verdampfungsenthalpie beträgt 21,8 kJ·mol−1.[6] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend
im Temperaturbereich von 232,4 K bis 358,5 K.[7] Festes Chlordifluormethan schmilzt bei −157,27 °C mit einer molaren Schmelzenthalpie von 4,12 kJ·mol−1.[8] Der Feststoff tritt in zwei polymorphen Kristallformen auf. Ein Lamda-Phasenübergang von Form II zu Form I erfolgt bei −214 °C.[8] Die kritische Temperatur liegt bei 96 °C, der kritische Druck bei 49,10 bar.[9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Chlordifluormethan wird als Zwischenprodukt bei der Herstellung von Polytetrafluorethylen verwendet. Der Stoff wurde früher vorwiegend als Kältemittel in Kompressionskälteanlagen eingesetzt. Atmosphärisches R22 schädigt die Ozonschicht, allerdings weniger als die vollhalogenierten Kohlenwasserstoffe. Daher wurde es zeitweise als Ersatzstoff für R12 genutzt und die Übergangszeiten bis zum Verwendungsverbot nach der FCKW-Halon-Verbots-Verordnung waren länger. Seit 1. Januar 2000 ist es laut Montreal-Protokoll verboten, R22 für die Verwendung in neuen Anlagen oder mit R22 bereits befüllte Anlagen zu importieren, herzustellen oder zu handeln. Seit dem 1. Januar 2010 darf nur noch recyceltes R22 verwendet werden. Ab 2015 wurden Produktion und Import auf 10 % des Verbrauchs von 1989 für jedes Land beschränkt und ab 2020 ganz verboten. Die Nutzung von recyceltem R22 war bis 2015 erlaubt.[10]
Gefahren
[Bearbeiten | Quelltext bearbeiten]Bei Verbrennung von Chlordifluormethan in Gegenwart von Metall und Kohlenstoff (z. B. beim Zulöten alter Kupferleitungen von Kühlschränken oder Kälteanlagen) kann das Giftgas Phosgen entstehen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu HYDROCHLOROFLUOROCARBON 22 in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Dezember 2021.
- ↑ a b c d e f g h i j Eintrag zu Chlordifluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-45-6 bzw. Chlordifluormethan), abgerufen am 2. November 2015.
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑ Kudchadker, A.P.; Kudchadker, S.A.; Shukla, R.P.; Patnaik, P.R.: Vapor pressures and boiling points of selected halomethanes in J. Phys. Chem. Ref. Data 8 (1979) 499, doi:10.1063/1.555600.
- ↑ D. R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Ind. Eng. Chem. Band 39, 1947, S. 517–540., doi:10.1021/ie50448a022
- ↑ a b Neilson, E.F.; White, D.: The heat capacity, heat of fusion, heat of transition and heat of vaporization of chlorodifluoromethane between 16 K and the boiling point in J. Am. Chem. Soc. 79 (1957) 5618–5621.
- ↑ Hanhai Dong; Yi Liu; Yuxiao Li; Dongfeng Zhao: Effect of initial temperature on explosion characteristics of 2,3,3,3–Tetrafluoropropene In: J. Loss Prev. Proc. Ind. 68 (2020) 104324, doi:10.1016/j.jlp.2020.104324.
- ↑ Johnson-Controls: Der R22 Ausstieg und die F-Gase-Verordnung ( vom 14. November 2014 im Internet Archive) (PDF; 158 kB).



