Sulfato
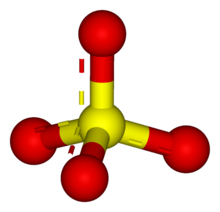
Sulfatoak azido sulfurikotik datozen gatzak edo esterrak dira[1]. Unitateko egitura komun bat dute: sufrea tetraedro baten erdian kokatzen da, eta erpinak lau oxigeno atomok osatzen dituzte. Sulfato-gatzak, -azidoak eta -peroxidoak hainbat industriatan erabiltzen dira; adibidez, kimikan, eraikuntzan eta nekazaritzan, dituzten ezaugarri eta aplikazio ugariengatik.
Sulfatoaren egitura
[aldatu | aldatu iturburu kodea]Bai sufrea bai oxigenoa taula periodikoko VI. taldean daude. Talde honetako elementuek 6 balentzia-elektroi dituzte. Balentzia-elektroiak atomo baten kanpoko geruzan dauden elektroiak dira, eta atomoaren lotura dute eginkizun.
Sulfatoaren Lewis-en egitura marraztean, sufrea egituraren erdian jartzen da, atomo elektronegatiboena delako. Gainerako lau oxigeno atomoak sufrearen inguruan kokatzen dira. Sufre eta oxigeno atomo bakoitzak bi elektroi ditu, eta lau lotura sinple eratzen dituzte. Gainerako 24 elektroiak kanpoko oxigeno atomoen inguruan jartzen dira. Lewisen egitura horretan, zortzikotearen araua betetzen da. Arau horren arabera, atomoek elektroiak irabazi edo galduko dituzte, kanpoko geruzan 8 elektroi lortzeko. Sulfatoaren Lewisen egitura marraztean, lotura sinpleak besterik ez daude, eta zortzikotearen araua betetzen da.
Balentzia-geruzako elektroi bikoteen aldarapenaren teoriaren arabera (VSEPR), sulfatoak geometria tetraedrikoa du. Izan ere, sulfatoak 4 atomo ditu erdiko atomoaren inguruan, eta zero elektroi bikote bakarti erdiko atomoaren inguruan. Oxigeno atomo bakoitzaren arteko angeluak 109,5 gradukoak dira.
Sulfatoa ez da metala. Sufre atomo batek eta lau oxigeno atomok osatzen dute. Oxigenoa eta sufrea ez-metalak dira. Sulfatoa gai da Al2(SO4)3 aluminio sulfatoa eta MgSO2 magnesio sulfatoa bezalako metalekin lotzeko.
Sufrearen eta oxigeno atomo bakoitzaren arteko lotura kobalentea da. Lotura kobalenteak eratzen dira metalak ez diren atomoen artean elektroiak partekatzen direnean. Ez-metalek elektroiak irabazi nahi izaten dituzte beren zortzikotea osatzeko. Hori dela eta, elektroiak partekatzen dituzte beren zortzikotera iritsi ahal izateko[2].
Sulfatoaren propietate kimikoak
[aldatu | aldatu iturburu kodea]- Masa molarra= 96,07 g/mol
- Irakite-puntua = 623,9 ºC
- Fusio-puntua = 270,5 ºC
- Uretan disolbagarria
- Sulfatoa hidrogeno sulfato ioiaren (HSO−4) base konjugatua da.
- Hidrogeno sulfato ioiak sulfato ioiaren (SO2−4) azido konjugatua da
- Erraz lotzen da metalekin
Sulfato arrunten motak
[aldatu | aldatu iturburu kodea]Sulfatoak bi mota nagusitan sailkatu daitezke: sulfato ez-organikoak eta sulfato organikoak.
Sulfato Ez-organikoak
[aldatu | aldatu iturburu kodea]Sulfuro batzuk oxidatzen direnean sortzen dira. Sulfato ohikoenak, alor honetan, sulfato metalikoak izaten dira.[3]
Zn + H2SO4 → ZnSO4 + H2; Kasu honetan, Zn metalaren oxidazio-erreakzioa izaten da, Zn (0)-tik Zn(+2)-ra.
Cu(OH)2 + H2SO4 → CuSO4 + 2 H2O; Kasu honetan, Cu metalaren oxidazio-erreakzioa izaten da, Cu (0)-tik Cu(+2)-ra.

CdCO3 + H2SO4 → CdSO4 + H2O + CO2
Kasu honetan, Kadmio metalaren oxidazio-erreakzioa izaten da, Cd (0)-tik Cd(+2)-ra.
Beste alde batetik, sulfato gatz inorganiko batzuk naturan aurkitu ahal dira, hala nola CaSO4.2H2O, BaSO4 eta Na2SO4. Sulfato kaltziko dihidratatua naturan igeltsu gisa aurkitzen da. CaSO4 1/2H2O + 3/2H2O ⇆ CaSO4.2H2O
Sodio sulfatoaren erreakzioa honela definitzen da.
2NaOH + H2SO4 → Na2SO4 + 2H2O
Bario sulfatoa baritina mineral bezala aurki daiteke naturan. Beste alde batetik, laborategietan ere sintetiza daiteke bario kloruroa azido sulfurikoarekin erreakzionaraziz.
H2SO4 + BaCl2 → BaSO4 + 2HCl
Sulfato organikoak
[aldatu | aldatu iturburu kodea]Sulfato organikoak Organosulfuro modura definitzen dira, eta konposatu organikoen klase bat dira, R−O−SO egiturarekin talde funtzional komun bat partekatzen duena; R-O-SO -3 . SO4 nukleoa sulfato talde bat da, eta R taldea edozein erradikal organiko izan daiteke. Organosulfatoak azido sulfurikoa (H2SO4) edo azido eratorriko konposatu batek eta alkohol batek (R-OH) erreakzionatzen dutenean sortzen dira. Horren ondorioz, neutralizazio-erreakzioa gertatzen da, eta produktu gisa gatza (esterra) eta ura sortzen da. Sulfato-ester asko detergenteetan erabiltzen dira, eta batzuk erreaktibo erabilgarriak dira. Alkiloko sulfatoak hauek dira: hidrokarburo-kate hidrofobiko bat, sulfato polar talde bat (anioi bat duena) eta katioi bat edo amina bat sulfato-taldea neutralizatzeko. Hurrengo ekuazioetan sulfato organikoen 3 erreakzio desberdinetan adierazten dira.

Lehenengo erreakzioan, alkohol talde funtzionalak eta azido sulfurikoak erreakzionatzen dute.
ROH + H2SO4 → R2SO4 + H2O
Kasu honetan, azido klorosulfurikoa alkiloko sulfatoak egiteko erabiltzen da
ClSO3H + RCH2OH → RCH2OSO3H + HCl
Kasu honetan, trioxido sufrea ere alkiloko sulfatoak egiteko erabiltzen da[4].
SO3 + RCH2OH → RCH2OSO3H
Sulfatoen erabilerak
[aldatu | aldatu iturburu kodea]Sulfatoen aplikazioak asko aldatzen dira lotuta dauden metalaren arabera. Sodio sulfatoa, adibidez, beiraren fabrikazioan erabiltzen da, detergenteen gehigarri gisa, etab.; kobre sulfatoa likaren fabrikazioan erabiltzen da da prozesu jakin baten arabera; ongarrien fabrikazioan, pestizida gisa ere erabiltzen da, etab.
Igeltsua eta barita eraikuntzan erabiltzen dira, eta gehigarri gisa papera eta kartoi mehea egiteko. Bario sulfatoa medikuntzan ere erabiltzen da kontrastezko erradiografiak egiteko.
Sulfatoak gatz bikoitz batzuen funtsezko osagaiak dira, hala nola AB(SO4)2 · 12 H2O formula orokorreko alunbreak; A eta B (+1) eta (+3) karga duten katioiak dira, hurrenez hurren. Ezagunena sodioz eta aluminioz osatutako sodio-alunbrea da (8).
Sulfatoak edertasun- eta higiene-produktuetan
[aldatu | aldatu iturburu kodea]Sodio lauril sulfatoa (SLS) apar-eragile gisa erabiltzen den produktu detergentea da; hau da, ura ukitzean aparra egiteko higiene- eta edertasun-produktuei gehitzen zaie eta, batez ere, larruazala eta ilea garbitzeko eragile gisa erabiltzen dira halako produktuak.
Hala ere, pertsona batzuk oso sentikorrak dira sodio-sulfatoak dituzten produktuen aurrean, lehortasuna, azkura, zolda sortzen dutelako, eta ileak maneiukortasuna galdu eta azala ere oso koipetsu bihur daitekeelako bere olio naturalen galera konpentsatzen saiatzean. Beraz, norberak azala oso sentikorra badu edo alergiak edo ekzema izanez gero, hobe da sulfatorik gabeko produktuak erabiltzea.
Sulfatoak medikuntzan
[aldatu | aldatu iturburu kodea]
Magnesio sulfatoa medikuntzan gehien erabiltzen den gatza da, eta ahotik, zain barnetik, muskulu barnetik edo lainoztatuta eman daiteke, asma-krisiak tratatzeko bai eta “status asmatikoan”, zain barnetik zein lainoztatuta. Gainera, haurdunaldiko konplikazio larriak diren preeklanpsia eta eklanpsia tratatzeko ere erabiltzen da. Magnesio sulfatoa ere ikertzen ari dira, kolon eta ondesteko minbizia tratatzeko erabiltzen diren zenbait sendagairen albo-ondorio toxikoak prebenitzeko duen gaitasunagatik, konbultsioen aurkako sendagai gisa funtzionatzen baitu. Horrez gain, magnesio sulfatoa desinfektatzeko ere erabiltzen da, kilo erdi magnesio sulfato disolbatuz litro bat ur berotan, tenperatura jasangarri batean, eta kotoi-konpresak ipiniz tratatu beharreko gunean.
Sulfatoak pinturetan, estalduretan eta plastikoetan
[aldatu | aldatu iturburu kodea]Barita edo bario sulfatoa estalduretan erabiltzen da, korrosioarekiko erresistentziagatik eta inertzia kimikoagatik. Ez du beste produktu kimikoekin erreakzionatzen, eta ez da kolore horikoa bihurtuko. Barita hauts zuri distiratsua da, kolore neutroko oinarri gisa erabil daiteke kolore-konposatu guztietarako eta TiO2-aren hedatzaile gisa pintura eta estalduren konposatuetan.
Bario sulfatoa plastikoetan ere erabiltzen da, erretxinaren eskaria murrizteko. Baritaren dentsitatea aglutinatzaile mineral gehienak baino askoz handiagoa denez, plastikozko piezak dentsoago bilakatzeko eta kostua murrizteko erabiltzen da. Bario sulfatoaren errefrakzio-indizea oso altua da eta titanio dioxidoak bakarrik gainditzen du.
Sulfatoak hainbat industriatan erabiltzen diren arren, sulfatoek kalte egin diezaiekete hormigoi eta zementu eraikuntzei, batez ere sulfato-eduki handien eraginpean daudenean.
Sulfatoen erasoa hormigoiari edo betoiari
[aldatu | aldatu iturburu kodea]Batzuetan, lurrean aurkitzen dira sodio-, potasio-, kaltzio- edo magnesio-sulfatoak, edo lurrean dagoen uretan disolbatuta, edo agregatuetan egoten dira; adibidez, piritan. Sulfatoak produktu kimikoen, baterien, aluminioaren eta meatzaritzaren fabrikaziotik eratorritako industria-hondakinetan egon daitezke. Hozte-dorreetan erabiltzen den urak ere sulfatoak izan ditzake, lurrunketa bidezko metaketaren ondorioz.
Bi erreakzio kimiko motaren ondorioz erasotzen diote sulfatoek hormigoiari.
Sulfatoaren erreakzioa zementua hidratatzean askatutako kaltzio hidroxidoarekin, kaltzio sulfatoak (igeltsua) eratzeko.
Kaltzio sulfatoaren eta kaltzio aluminato hidratatuaren arteko erreakzioa, kaltzio sulfoaluminatoa eratzeko (etringita).
Erreakzio horiek areagotu egiten dute solidoen bolumena, eta, ondorioz, hedatu eta deskonposatu egiten dira sulfato-disoluzioen eraginpean dauden solidoak. Zehaztu behar da sulfatoek oso gutxitan erasotzen diotela hormigoiari, forma solidoan edo lehorrean badago. Sulfatoek, hormigoian kalte nabarmena eragin ahal izateko, disoluzioan eta kontzentrazio minimoan egon behar dute.
Sulfatoek hormigoian eragin dezaketen kaltea honako ezaugarri hauen araberakoa da: sulfato mota, kontzentrazioa, disoluzioa geldi dagoen edo jariatzen ari den, presioa, tenperatura eta sulfato-disoluzioan beste ioirik dagoen.
Motari dagokionez, magnesio eta amonio sulfatoak dira kaltegarrienak. Kontzentrazioari dagokionez, sulfatorik disolbagarrienak kaltegarriagoak dira. Sulfatoak dituen ura geldi egon beharrean jariatzen bada, kalte handiagoa egin diezaiokete hormigoiari. Presioak kaltea eragiten du, hormigoian dagoen sulfatoaren disoluzioa behartzeko joera baitu. Tenperaturak ere eragina du, sulfatoen aurrean zementuaren erreakzioa areagotzen baitu.
Sulfatoaren disoluzioan, itsasoko uretan bezala, beste ioi batzuk egoteak (sulfatoak eta kloruroak ditu itsasoak) aldatu egiten du erreakzio kimikoaren hedadura eta izaera, eta hedapen txikiagoa eragiten du, itsasoko uretako sulfatoen eraginez.
Sulfatoen aurrean erresistenteak diren zementuak
[aldatu | aldatu iturburu kodea]Sulfatoek hormigoiari eraso egiten diote sulfato-disoluzioa hartan sartzen denean eta hormigoiaren osagaiekin erreakzionatzen duenean, batez ere zementu-matrizearekin, eta horrek eragina du haren erresistentzian eta iragazkortasunean.
Eraikuntza-industrian, sulfatoen aurrean erresistenteak diren zementuak garatu dira; adibidez, Portland zementuak, aluminato trikaltziko gutxi dutelako (% 5 baino gutxiago). Ondorioz, sulfatoen aurrean erresistenteak dira, eta mundu osoko zementu-araudi eta -arau askotan erabiltzen dira espezifikazio-irizpide gisa. Zementu horiek konposizio kimiko eta fisiko berezia dute, sulfatoen erasoa edo pitzadura gutxitzen edo desagerrarazten duena, eta egituren iraunkortasuna areagotzen duena.
Sulfatoen aurrean erresistenteak diren zementuek likidoen eta gasen iragazkortasuna murrizten dute, eta ez dute substantzia kaltegarririk sartzen barrura. Hala, handitu egiten da eraso kimikoa jasan duen egituraren balio-bizitza. Zementu mota horren konposizioa dela eta, sulfatoaren hedatze-erreakzioetarako behar diren elementu gutxi dituzte. Goi-mailako akabera eta biskositate hobetua eskaintzen dute, ohiko hormigoi batekin alderatuta. Horrez gain, errefortzu-altzairuari ere babesa ere ematen diote.
Sulfatoen aurrean erresistenteak diren zementuen erabilerak eta aplikazioak
[aldatu | aldatu iturburu kodea]Sulfatoen aurrean erresistenteak diren zementuak hondakin-urak bilduko dituzten tangak eraikitzeko erabiltzen dira, sulfato-karga handiak (10.000 ppm-raino, SO4 gisa adierazia) dituzten urak ukitzen dituzten zimenduetan. Itsasoko urarekin kontaktuan dauden egituretan ere erabiltzen dira, hala nola zimenduetan eta malguki-plataformetan, bai eta sulfatoak edo lurpeko urak dituzten lurzoru edo lurretan ere.
Horietako batzuek NSR-10 arauak zehaztutako ezaugarriak betetzen dituzte, S1, S2 eta S3 sulfatoen esposizio-kategoriarekin [5].
Ondorioak
[aldatu | aldatu iturburu kodea]Sulfatoa funtsezko ioia da hainbat erreakzio kimikotan eta prozesu biologikotan, eta bereziki aipagarriak dira duen rola funtsezko konposatuen eraketan eta duen gaitasuna metalekin elkarreragiteko. Duen 96,07 g/mol-ko masa molarrak, irakite- eta fusio-puntuekin batera, konposatu interesgarri bihurtzen dute industria- eta ingurumen-aplikazio askotarako. Sulfatoak uretan duen disolbagarritasunak, halaber, nabarmen bihurtzen du uretako sistemetan duen garrantzia eta uraren kalitatean duen eragina.
Hamarkada honetan, agerian geratu da sulfatoak duen garrantzia lurzoruen kimikan, ongarrietan duen erabileran eta ekosistemen azidotzean duen zereginean. Gainera, metalekin duen interakzioak iradokitzen du laguntza handikoa izan daitekeela hondakin-uren tratamenduan eta ingurumenaren berreskurapen-prozesuetan.
Etorkizuneko ikerketarako gomendioak hauek izan daitezke:
- Inguruaren inpaktua aztertzea: Sulfatoen kontzentrazioen aldaerek ur eta lur ekosistemetan duten eragina ikertzea, ikerketa sakonagoa eginez bereziki azidotzaileen aurrean sentikorra den eremuan.
- Tratamendu teknologiak garatzea: Uraren tratamenduan sulfatoak ezabatzeko teknologiak esploratzea, tratamendu biologiko eta fisiko-kimiko metodo eraginkorragoak eta iraunkorragoak barne.
- Metalekiko interakzioa: Sulfatoak beste metalekin konplexuak sortzeko duen gaitasuna ikertzea, eta horrek zer abantaila ekar dezakeen industria-prozesuetan edo mineralen estrakzioan.
- Ekoizpen arloko aplikazioak: Sulfato iturriek duten efektua lurraren osasunean eta uzta-hazkuntzan ebaluatzea, eta beste mantenugai batzuk eskuragarri izateko duen eragina[6].
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ Perry, Robert H., ed. (2008). Perry's chemical engineers' handbook. (8. ed. argitaraldia) McGraw-Hill ISBN 978-0-07-142294-9. (Noiz kontsultatua: 2024-11-08).
- ↑ (Ingelesez) SO42 Lewis Structure, Molecular Geometry, Hybridization, and Polarity - Techiescientist. 2021-03-04 (Noiz kontsultatua: 2024-11-10).
- ↑ Chemistry of the Elements (2nd ed.).. ISBN ISBN 978-0-08-037941-8...
- ↑ (Ingelesez) Holmberg, Krister. (2019-07-23). «Surfactants» Ullmann's Encyclopedia of Industrial Chemistry (Wiley-VCH Verlag GmbH & Co. KGaA): 1–56. doi:. ISBN 978-3-527-30673-2. (Noiz kontsultatua: 2024-11-08).
- ↑ (Gaztelaniaz) Possehl. (2022-07-13). Sulfatos utilizados en la industria de la alimentación animal – Possehl. (Noiz kontsultatua: 2024-11-08).
- ↑ «Sulfate Interactions with Metals in Industrial and Wastewater Treatment Applications» Industrial Chemistry and Engineering: 556-563..
