Telán
| Telán | |
 | |
 | |
| Všeobecné vlastnosti | |
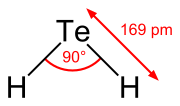
| Sumárny vzorec | H2Te |
| Systematický názov | Telán |
| Synonymá | Telurovodík, kyselina telurovodíková |
| Vzhľad | bezfarebný plyn |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 129,6158 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 7783-09-7 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Telán je anorganická zlúčenina telúru s vodíkom. Je to najjednoduchší chalkogenovodík telúru. Telán je bezfarebný plyn, ktorý je v okolitom vzduchu nestabilný, ale dokáže existovať dostatočne dlho na to, aby ho bolo možné ľahko identifikovať podľa vôňe hnilého cesnaku i pri extrémne nízkych koncentráciách alebo podľa vône hnilého póru pri vyšších koncentráciách. Väčšina zlúčenín s Te–H väzbami (teluroly) sú nestabilné a štiepi sa z nich elementárny vodík, H2. Telán je chemicky i štruktúrne podobný selánu, oba sú kyslé. Uhol H–Te–H je asi 90°. Prchavé zlúčeniny telúru majú často nepríjemnú vôňu, podobnú rozkladajúcemu sa cesnaku alebo póru.[1]
Syntéza
[upraviť | upraviť zdroj]Na syntézu telánu boli vyvinuté elektrolytické metódy.[2]
Telán možno pripraviť aj hydrolýzou teluridov s elektropozitívnymi kovmi.[3] Typickou hydrolýzou s takýmto priebehom je hydrolýza teluridu hlinitého:
- Al2Te3 + 6 H2O → 2 Al(OH)3 + 3 H2Te
Takisto možno použiť iné soli Te2−, napríklad telurid horečnatý, MgTe, a telurid sodný, Na2Te. Telurid sodný možno vytvoriť reakciou sodíka s telúrom v bezvodom amoniaku.[4] Intermediát vznikajúci počas hydrolýzy, HTe-, možno takisto izolovať ako soľ. Hydrogentelurid sodný, NaHTe, vzniká redukciou telúru s tetrahydroboritanom sodným.[4]
Telán nie je možné pripraviť dostatočne účinne z jeho zložiek (vodíka a telúru), na rozdiel od selánu.[2]
Vlastnosti
[upraviť | upraviť zdroj]Telán je endotermická zlúčenina, takže sa pri izbovej teplote rozkladá na jednotlivé prvky:
- H2Te → H2 + Te
Svetlo urýchľuje rozklad telánu. Je nestabilný na vzduchu, pričom sa oxiduje na vodu a telúr:[5]
- 2 H2Te + O2 → 2 H2O + 2 Te
Telán je takmer tak kyslý ako kyselina fosforečná (Ka = 8.1×10−3, pKa = 2,09) a má Ka asi 2.3×10−3 (pKa = 2,63).[5] Reaguje s mnohými kovmi, čím vznikajú teluridy.[6]
Referencie
[upraviť | upraviť zdroj]- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ a b F. Fehér, "Hydrogen Telluride" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. pp. 438.
- ↑ Shriver, Atkins. Inorganic Chemistry, Fifth Edition. W. H. Freeman and Company, New York, 2010; pp 407.
- ↑ a b Nicola Petragnani; Hélio A. Stefani. Tellurium in organic synthesis. 2nd. vyd. [s.l.] : Academic Press, 2007. ISBN 978-0-08-045310-1. S. 6.
- ↑ a b Egon Wiberg; Arnold Frederick Holleman. Inorganic chemistry. Ed. Nils Wiberg. [s.l.] : Academic Press, 2001. ISBN 0-12-352651-5. S. 589.
- ↑ Henry Enfield Roscoe; Carl Schorlemmer. A treatise on chemistry. [s.l.] : Appleton, 1878. S. 367–368.
Pozri aj
[upraviť | upraviť zdroj]Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Hydrogen telluride na anglickej Wikipédii.
