Thalidomide
| Thalidomide | |
| |
| Identification | |
|---|---|
| Nom UICPA | (RS)-2-(2,6-Dioxopipéridin-3-yl)isoindol-1,3-dione |
| No CAS | |
| No ECHA | 100.000.029 |
| No CE | 200-031-1 |
| Code ATC | L04 |
| DrugBank | APRD01251 |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
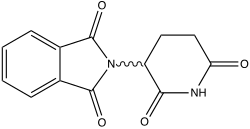
| Formule | C13H10N2O4 [Isomères] |
| Masse molaire[1] | 258,229 5 ± 0,012 7 g/mol C 60,47 %, H 3,9 %, N 10,85 %, O 24,78 %, |
| Propriétés physiques | |
| T° fusion | 270 °C[2] |
| Solubilité | 545 mg·l-1 (25 °C[2]) |
| Précautions | |
| Directive 67/548/EEC | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
| Thalidomide | |
| Informations générales | |
|---|---|
| Princeps | Thalidomide Celgene (France) |
| Identification | |
| No CAS | |
| No ECHA | 100.000.029 |
| Code ATC | L04AX02 |
| DrugBank | DB01041 |
| modifier |
|
Le thalidomide[3] est un médicament utilisé durant les années 1950 et 1960 anti-nauséeux chez les femmes enceintes, et comme sédatif.
Il a été découvert qu'il est à l'origine de graves malformations congénitales. Ces effets tératogènes sont dans un premier temps occultés ou niés, notamment par le fabricant Grünenthal GmbH (de). Dans un deuxième temps, ils font l'objet d'un scandale sanitaire qui aboutit au retrait du médicament du marché mondial à partir de 1961. Aujourd'hui, le thalidomide est utilisé de façon extrêmement contrôlée pour ses propriétés immunomodulatrices et antitumorales.
Synthétisé en Allemagne de l'Ouest par la firme pharmaceutique suisse Ciba en 1953, le thalidomide est repris par l'entreprise pharmaceutique Grünenthal GmbH en 1954 et mis sur le marché en 1957. De 1957 à 1961, le laboratoire allemand Chemie Grünenthal commercialise le thalidomide, prescrit partout dans le monde : Europe, Afrique, Amérique du Sud et Amérique Centrale, Asie et Océanie, pour ses effets contre les nausées chez les femmes enceintes. Alors que des documents sont demandés par l'agence de contrôle des médicaments américaine, afin de permettre sa commercialisation aux Etats-Unis, les médicaments contenant du thalidomide sont immédiatement retirés du marché. En quatre ans, d'utilisation, on compte plus de 20 000 victimes dans le monde, dont 3 000 en Allemagne.
En ce début du XXIe siècle, la moitié des personnes affectées sont encore en vie, mais elles sont porteuses de handicaps moteurs lourds, occasionnés par les médicaments. Des études qui sont toujours en cours laissent penser que la molécule pourrait passer par l'inhibition de la transcription de l'ADN et en conséquence de l'angiogenèse du foetus[4], ce qui causerait ces malformations. Les effets tératogènes, responsables des malformations, se transmettraient par le truchement d'ADN[4]. Les enfants des personnes victimes pâtiraient donc de la présence d'effets tératogènes de la molécule, présente dans leur organisme.
Cette tragédie a eu un effet accélérateur important dans la mise en place de normes plus strictes de sécurité sanitaire pour la mise sur le marché des médicaments et des produits phytosanitaires, comme les pesticides. Ce scandale a été un déterminant de la création du centre mondial de pharmacovigilance, aujourd'hui basé à Uppsala en Suède[5].
Interdit pour son usage initial, le thalidomide fait depuis le début du XXIe siècle un modeste retour : il est testé dans des essais cliniques pour son efficacité possible sur le traitement de la lèpre, dans le traitement de certaines inflammations (par blocage du TNF), pour la maladie de Crohn, pour certains myélomes multiples avancés et quelques autres cancers spécifiques, pour lesquels ses effets tératogènes peuvent être utiles dans le traitement des patients, mais conservent leur dangerosité pour le corps humain (augmentation de la formation de caillots de sang et donc des problèmes cardiaques, notamment).
Histoire
[modifier | modifier le code]Du rapide succès mondial à la crise sanitaire
[modifier | modifier le code]Le thalidomide est d'abord[6] synthétisé en 1953 par Ciba qui, ne lui trouvant aucun effet pharmacologique notable, ne poursuit pas son développement. Au cours d'une recherche sur la production d'antibiotique, en chauffant du phtalate d'isoglutamine, Wilhelm Kunz — de Chemie Grünenthal[7] — synthétise lui aussi le thalidomide en 1954. Herbert Keller reconnaît dans cette substance un analogue de la glutethimide (en) dont la société Ciba a montré les qualités sédatives en 1952[8]. Des tests sur les animaux sont effectués.
Les tests de toxicité chronique sur l'animal (plusieurs lignées de lapins, souris, rates, hamsters et poules[9]) ainsi que les essais cliniques chez l'homme, effectués en 1956, ne démontrent alors aucune toxicité particulière[10].
Les performances du produit furent comparées avec celles des barbituriques, qui connaissaient à l'époque un très grand développement : alors qu'un surdosage - volontaire ou non - de barbituriques peut avoir des conséquences fatales, les chercheurs de Grünenthal affirment que le thalidomide, même à très hautes doses, n'avait pas d'autre effet que le sommeil ; en outre, aucun effet secondaire ne lui fut alors trouvé.
Les tests cliniques commencèrent immédiatement après la synthèse et le dépôt de brevet, en . La première publication traitant du thalidomide — sous l’appellation K17 — date de 1956[11]. Le , le Département de la Santé du Ministère de l'Intérieur du Land de Rhénanie-du-Nord - Westphalie donne son autorisation à la commercialisation du thalidomide. En , un imprimé donnait les indications suivantes : irritabilité, défaut de concentration, trac, éjaculation précoce, tension menstruelle, troubles de la ménopause, peur des examens, troubles fonctionnels de l'estomac, maladies infectieuses fébriles, anxiété, hyperthyroïdie et tuberculose[12].
En 1956, Grünenthal commercialisa d'abord le thalidomide sous l’appellation Grippex, un médicament contre la grippe[13]. À partir du , Grünenthal commercialise le thalidomide sous l’appellation Contergan — comme hypnotique — mais aussi le Contergan Forte ; il fut d'abord accessible sans prescription. Un an après, les ventes de Contergan atteignaient les 90 000 boîtes par mois[14]. Au Royaume-Uni, où les autorités encouragèrent la prescription d'un médicament considéré comme ayant fait ses preuves (« new remedies of proved value »[15]), il fut commercialisé — exempt de taxe — par Distillers Company en avril 1958 sous l’appellation Distaval, mais sur prescription médicale seulement. Très rapidement, le médicament fut mis en circulation dans la plupart des pays occidentaux, sous différentes dénominations[16]. Il ne fut distribué ni en Chine ni en URSS ni en Inde.
Combiné à d'autres substances, le thalidomide fut présent dans différents médicaments[17] ; en 1962, le service de santé publique de Zurich recense cinquante-cinq médicaments contenant le produit[18]. Au niveau mondial, le thalidomide fut commercialisé sous plus de soixante-huit marques différentes.
En 1958, Grünenthal lance une campagne publicitaire de grande ampleur. La société adressa un courrier à 40 000 médecins pour les inciter à prescrire le Contergan et le Contergan Forte notamment aux femmes enceintes[19] (en , Distillers fait à son tour activement savoir que le thalidomide pouvait sans aucun danger être prescrit aux femmes enceintes).
Lors d'un congrès tenu du au , le neurologue Ralf Voss évoque les neuropathies périphériques entraînées d'après ses observations par le thalidomide.
En , Grünenthal mentionne dans les notices d'utilisation le risque de neuropathies périphériques — qu'elle qualifie alors de réversibles — lors d'utilisation prolongée.
En , le British Medical Journal publie un article liant le thalidomide à des neuropathies périphériques.
Le , lors d'un congrès de neurologie à Düsseldorf, le Dr Ralf Voss fait une communication sur les névrites périphériques sévères et irréversibles causées par le thalidomide : le , les autorités fédérales recommandent de soumettre la vente de thalidomide à une prescription médicale[20]. Néanmoins, la documentation commerciale à destination de l'étranger insistait toujours sur l'innocuité de ce produit[21]. L'obligation d'en passer par une prescription ne devint effective que le premier [22], et ce, uniquement dans les Länder de Rhénanie-du-Nord-Westphalie, Hesse et Bade-Wurtemberg. À la suite de la publication, le [23], par le magazine Der Spiegel d'un article rapportant les lésions nerveuses causées par le thalidomide, les ventes de Contergan s'effondrent (les ventes passèrent en septembre de 1 170 478 DM à 595 528 DM). Des patients atteints de ces lésions demandent un dédommagement à Grünenthal.
La première publication, dans Die Medizinische Welt, de cas de malformations congénitales, a lieu en , par le directeur de la clinique pédiatrique municipale de Krefeld.
En , Karl Schulte Hillen, un avocat travaillant à Hambourg dont la femme et la sœur accouchèrent d'enfants malformés, contacte le Dr W. Lenz. Le , Hans Rudolf Weidemann attire l'attention sur l'augmentation du nombre d'enfants nés avec des difformités[24],[25]. Il introduit le terme de syndrome dysmélique, qui sera repris par Lenz et Mc Bride[26].
Le , Widukind Lenz fait un premier exposé lors d'un congrès de pédiatrie à Düsseldorf.
Le , une agence de presse publie un communiqué, peu remarqué, annonçant la décision du ministère de l'Intérieur de la région de Düsseldorf de supprimer l'autorisation de vente du Contergan à cause de risques tératogènes[27].
Le , paraît dans Welt am Sonntag un article du Dr Gerhard Prause évoquant les soupçons du Dr Lenz concernant un médicament (non nommé dans l'article)[28].

Le , Widukind Lenz, un généticien et médecin allemand travaillant à Hambourg, informe par téléphone Chemie Grünenthal qu'il soupçonne[29] le thalidomide d'être la cause de malformations congénitales ; il associe alors 130 naissances d'enfants malformés à la prise de thalidomide pendant la grossesse.
Le , Widukind Lenz fait un deuxième exposé lors d'un congrès de pédiatrie à Düsseldorf.
À la suite de la parution d'un article de Welt am Sonntag du titrant « Les alarmantes suspicions d'un chercheur contre un médicament distribué mondialement »[30], Grünenthal annonce le lendemain le retrait du Contergan du marché[31]. La société ne justifiait pas sa décision par les risques réels propres au thalidomide, mais avançait seulement l'impossibilité d'un débat scientifique dû à l'état de l'opinion publique[21]. C'est la mise au jour de ce qu'on appelle en langue allemande le Contergan Skandal. Le retrait ne devient effectif en Allemagne que le . Le , 5thalidomide est également retiré du marché britannique le .
Au Canada, il fut distribué aux femmes enceintes jusqu'en . En Irlande, le médicament fut disponible jusqu'en , en Espagne jusqu'en août. Au Japon, le retrait fut annoncé en , mais il ne fut totalement réalisé que fin 1963[32],[33]. En Belgique, les autorités avaient formulé une interdiction le , cependant, faute de suivi, les pharmacies se fournissaient encore en Softenon au printemps 1963[34] (l'arrêté interdisant la vente de Softenon n'ayant paru au Moniteur que le ).
Cas des États-Unis
[modifier | modifier le code]Aux États-Unis, Grünenthal passa un accord de licence en 1958[35] avec Vick Chemical Company dont la filiale, la société Richardson-Merrell, déposa une demande d'autorisation de mise sur le marché le pour son produit, le Kevadon.
D'après le Federal Food, Drug and Cosmetic Act de 1938, il appartenait à la FDA d'attester de son innocuité en un délai déterminé, éventuellement renouvelable. Le , le Dr Frances Oldham Kelsey, troublée notamment par l’exceptionnelle absence totale d'effets secondaires notifiés, demanda au laboratoire Richardson-Merrell un premier complément d'information[14] (Richardson-Merrell n'abandonna sa demande d'autorisation qu'en )[36].
Si le thalidomide ne fut pas commercialisé alors aux États-Unis, il fut tout de même administré à 20 000 patients[37] : croyant obtenir facilement l'autorisation de mise sur le marché (le thalidomide avait été autorisé dans de nombreux pays, dont le Canada), Richardson-Merrell avait distribué 2,5 millions de comprimés à plus d'un millier de praticiens, occasionnant ainsi une dizaine de victimes[20].
Cas de la France
[modifier | modifier le code]Bien que la France ait initialement pris des précautions dans la diffusion du thalidomide, des cas de malformations graves ont tout de même été constatés dans le pays, touchant des centaines de victimes, malgré certaines affirmations selon lesquelles la France aurait échappé à la tragédie. La molécule a causé des malformations congénitales sévères dans le monde entier, y compris en France, où elle a affecté des familles entières et engendré un long combat pour la reconnaissance des victimes.
Contrairement aux idées reçues, les victimes françaises n'ont pas bénéficié d'indemnisations ni d’une reconnaissance immédiate de leur condition par les autorités sanitaires et judiciaires. Ce n’est qu’après des années de lutte, notamment à travers la création d'associations d'aide, par et pour les victimes ainsi que leur famille, que leurs souffrances ont été reconnues et que des mesures ont été prises pour empêcher de nouvelles tragédies médicamenteuses. Aujourd'hui, les cas de thalidomide en France sont documentés et reconnus[38], démentant ainsi les idées reçues selon lesquelles le pays aurait échappé à la catastrophe grâce à des contrôles rigoureux. Ce déni initial a eu des répercussions importantes pour les victimes, privées de soutien et de justice pendant des décennies, et souligne l'importance d'une vigilance constante dans la pharmacovigilance pour protéger la santé publique.
Cas de la République démocratique allemande
[modifier | modifier le code]Il y eut également des victimes du Contergan en RDA — en 2007, le nombre de survivants était estimé à plus de huit[39] — mais leur nombre fut limité du fait de l'intervention du Prof. Dr. Friedrich Jung (de)[40],[41].
Le désastre du thalidomide
[modifier | modifier le code]La responsabilité du thalidomide est, non sans mal, progressivement établie par des données épidémiologiques, cliniques et expérimentales.
Une tragédie sanitaire
[modifier | modifier le code]
Le médicament fut donc mis sur le marché le dans environ 50 pays, mais pas aux États-Unis (la Food and Drug Administration ayant demandé un complément d'information[42]), sous au moins 40 noms différents (Softénon, Talimol, Kevadon, Nibrol, Sedimide, Quietoplex, Contergan, Neurosedyn, etc.).
Le , The Lancet publie une lettre intitulée Thalidomide and congenital abnormalities que lui a adressée William McBride (en), un obstétricien australien. La même année, au congrès allemand de médecine interne de Francfort, le professeur Hoff émet une communication pour alerter les collègues sur de nombreux cas de polynévrites, sans succès[42].
Le , le procureur d'Aix-la-Chapelle ouvre une enquête à la suite d'une plainte déposée par un patient reprochant au thalidomide de lui avoir causé une néphropathie. Ce même mois de , Chemie Gruewenthal adresse à des milliers de médecins une lettre les avertissant contre la prescription de thalidomide aux femmes en âge de procréer et appelant à retirer de la vente tous les médicaments contenant ce produit[42].
À Hambourg existait un centre d'épidémiologie qui surveillait le taux d'anomalies dans la population de la ville. Dès 1960, le pédiatre et généticien Widukind Lenz montra un effet tératogène sur le développement fœtal par une augmentation de la fréquence des anomalies des membres[42].
Ces anomalies « thalidomide » touchaient les membres de manière plus ou moins importante. Cela allait de l'amélie (absence de membre chez les « enfants phoque »), l'ectromélie (absence de l'extrémité du membre), la phocomélie (réduction du segment intermédiaire) aux anomalies mineures de la main comme la syndactylie. Les enfants présentent également des malformations du tube digestif, du cœur, de l'appareil génito-urinaire[42]. Découvrant ces données, le Dr Speirs, médecin de la maternité écossaise de Stirlingshire, prouva que sur dix mères ayant donné naissance à un enfant ayant ces malformations, neuf avaient pris du thalidomide[42].
Un seul comprimé pris durant la grossesse suffisait à causer des dommages irréversibles aux embryons[18].
Un scandale éthique
[modifier | modifier le code]Cet essai clinique, déjà très critiqué dans sa méthode à l'époque, était alors sans précédent aux États-Unis, où un médicament n'avait encore jamais été testé sur plus de 5 000 patients ou distribué à plus de 200 médecins[43]. Les comprimés de thalidomide avaient été si largement distribués, parfois sans aucune mention du produit, qu'il s'avéra difficile de savoir qui en avait pris ou qui pouvait encore en prendre : lors d'une émission de télévision, le Président Kennedy dut lui-même exhorter les Américains à vérifier le contenu de leur armoire à pharmacie et à en retirer tout médicament non identifiable[43].
Scandale judiciaire
[modifier | modifier le code]Au Japon, plusieurs procès s'ouvrirent en 1963 qui débouchèrent sur un accord en .
En Allemagne, un premier procès, civil, s'engagea en à Hambourg.
Tandis qu'une partie des parents de victimes, autour de Helmut Hering, privilégie la recherche d'un accord avec Grünenthal, un autre groupe autour de l'avocat Schulte-Hillen choisit la voie judiciaire. Les 13/, le procureur d'Aix-la-Chapelle, le Dr Gierlich, décide d'engager des poursuites contre différents responsables de Grünenthal[44],[45].
Lors du procès qui dure de 1968 à 1970 — alors le plus long procès en RFA depuis ceux de Nuremberg — ce sont 400 plaignants, défendus par 7 avocats, qui s'opposeront à la Société Grünenthal défendue par 20 avocats. Le procès s'ouvre le dans le casino d'Alsdorf ; l'acte d'accusation porte sur les chefs suivants : homicide involontaire, agression et négligence intentionnelle. « Un des arguments de la défense était que grâce au thalidomide, des fœtus atteints de malformations spontanées normalement fatales avaient pu survivre[46] ». Le , la société et les avocats des plaignants s'accordent au terme d'une entente à l’amiable : les dirigeants de la Chemie Grünenthal ont convaincu les avocats des plaignants d'abandonner leur poursuite au pénal pour éviter la faillite de la firme qui priverait les victimes de tout dédommagement.
En échange, ils ont créé une fondation — Hilfswerk für behinderte Kinder — chargée d'indemniser ces victimes[47] : en 1991, 538 millions de Deutsche Mark ont été versés à 2 866 victimes[48]. Le , le procès prend fin. Le , une loi fédérale (BGBl. I, Nr. 131, S. 2018 ff.) prévoit la création d'une fondation, créée le sous le nom d’Hilfswerk fur behinderte Kinder[49].
Au Royaume-Uni, le procès dura jusqu'en 1972. Le Thalidomide Trust fut institué en 1973 afin d'indemniser les victimes britanniques grâce à un financement assuré par la Distillers Biochemicals Ltd (en). En , le gouvernement britannique annonça la dotation de vingt millions de livres sterling au Thalidomide Trust ; à la même occasion il annonça qu'il présenterait ses excuses aux victimes devant le Parlement[50]. Le , présentant officiellement cette dotation devant les Communes, le ministre britannique de la santé, saluant le travail du Thalidomide Trust, exprima sa compassion pour les victimes, les « thalidomiders » comme elles se désignent elles-mêmes[51].
Aux États-Unis, en , la mère d'une fille handicapée poursuit Richardson-Merrell. Une entente à l’amiable met fin au procès.
En Italie, aucune condamnation ne fut prononcée[52].
En Belgique, le thalidomide était vendu sous la marque Softénon et fut associé à un procès qui s'est déroulé en novembre 1962. L'origine de cette affaire remonte à la naissance, à la maternité de Rocourt, d'une petite fille atteinte de graves malformations, notamment l'absence d'anus, qui l'aurait fait de toute façon mourir à brève échéance. Devant le refus des autorités médicales d'euthanasier le nourrisson, les parents prennent la décision de lui administrer, mélangé au lait de son biberon, un puissant somnifère. Averti par un appel téléphonique, le Parquet demande qu'un agent de police soit envoyé au domicile des parents le lendemain de la mort du bébé. Informé du décès, le policier rédige un rapport, aussitôt transmis au Parquet : c'est alors que débute l'enquête. L'autopsie révèle la présence, dans l'organisme du bébé, de somnifère à dose mortelle. Appréhendée, la mère passe aux aveux et est placée sous mandat d'arrêt. Par la suite, sa sœur, son époux, sa mère ainsi que le médecin de famille, le docteur Casters, qui a délivré l'ordonnance pour le médicament, sont également arrêtés et écroués à la prison Saint-Léonard, à Liège. Il y attendent leur procès en cour d'assises, qui débute le . L'opinion publique, largement favorable à l'acquittement des accusés, suit attentivement les débats. L'événement connaît une vaste médiatisation : plus d'une centaine de journalistes assistent aux audiences, certains ayant fait le déplacement depuis l'Allemagne, la France, l'Italie, la Grande-Bretagne, les Pays-Bas, la Suisse ou encore la Suède. La presse se fait l'écho des discussions passionnées qui opposent partisans de l'euthanasie et défenseurs du droit à la vie. Le 10 novembre, une foule de plusieurs centaines de personnes s'est réunie sur la place Saint-Lambert dans l'attente de la décision des jurés. Le verdict tranche : les 5 accusés sont acquittés. La décision réjouit ceux qui, dès le début de l'affaire, ont soutenu les inculpés, notamment au nom du principe « On ne peut justifier, mais on peut comprendre »[53].
En , l’État a implicitement reconnu sa responsabilité quand la ministre de la Santé et des Affaires sociales a annoncé la création d'une fondation. Le , treize victimes intentent une action judiciaire contre l’État belge.
Conséquences réglementaires
[modifier | modifier le code]Si le thalidomide n'eut qu'un impact sanitaire limité aux États-Unis, il produit cependant un impact législatif certain. Arrivant à la connaissance du législateur au moment où le sénateur Estes Kefauver menait une campagne — peu suivie de succès — pour une réforme notamment de la politique de prix des médicaments, l'affaire du thalidomide donna l'occasion d'une modification de la législation américaine à travers le Kefauver-Harris Amendment to the Federal Food, Drug and Cosmetic Act : désormais, les autorités sanitaires — et c'était une première mondiale — avaient l'obligation d'attester, non plus seulement de l'innocuité, mais aussi de l'efficacité des médicaments mis sur le marché[54].
En 1961 en Suède est adopté la Läkemedelslag. La même année la Commission de la Communauté Européenne adopte la directive 65/65[55] qui est adoptée par le Conseil le (J.O. 22, ) : les autorités communautaires ont de cette façon directement contribué à la mise en place de systèmes de délivrance d’AMM dans tous les pays de la Communauté.
Le , à l'occasion de la quinzième Assemblée Mondiale de la Santé, l'OMS émet des recommandations. En 1973, à l'occasion de la troisième conférence internationale sur les malformations congénitales (birth defects), est décidée la mise en place de la International Clearinghouse for Birth Defects Monitoring Systems[56].
Le , l'Allemagne adopte l’Arzneimittelgesetz — qui n'entre en vigueur qu'en 1978. En Allemagne, le scandale du thalidomide marque profondément la conscience publique ; les mesures prises à son issue servent ensuite de modèle lors de la catastrophe du sang contaminé[57].
En Angleterre, dans le sillage de l'affaire est d'abord créé un sous-comité pour la sécurité des médicaments qui produit un rapport, the Cohen report, d'après le nom de son président Lord Cohen. Puis un comité pour la sécurité des médicaments — connu sous l’appellation Dunlop Comittee (en) — est institué en 1963. Ce CSD, qui n'a pas de pouvoir règlementaire, produit notamment le Yellow Card Scheme qui collationne tous les effets secondaires des médicaments. Dans le prolongement de ces préoccupations est adopté en 1968 the Medecine Act[58].
Prise en charge thérapeutique des victimes
[modifier | modifier le code]Autres conséquences
[modifier | modifier le code]
L'affaire entraîna également une modification notable du droit de la presse en Grande-Bretagne[59].
En 1962, Denise Legrix, touchée par « l’affaire de la thalidomide » de Liège[60], fait un appel aux dons ; en 1968, grâce à l'argent récolté, est édifié l'Institut National de Réadaptation à Saint Maurice. Le est créée l’Association des Victimes de la ThaLidomide en France, années 1950-1960 (AVITHAL). L'ASBL Victimes de la Thalidomide en Belgique est créée en .
Après le retrait du thalidomide, un débat éthique s'est ouvert, posant le problème moral de l'interruption médicale de grossesse chez les femmes l'ayant déjà absorbé[61]. Ainsi aux États-Unis, le désarroi de Sherri Finkbine (en) fit la une des médias.
C'est le scandale de ce médicament qui a renforcé la pharmacovigilance coordonnée au niveau mondial.
En 2005, C. Friedrich, regrettant l’absence d'intérêt des historiens pour l'affaire du thalidomide, se félicitait de l'ouverture des archives du procès, saluant au passage le travail de Beate Kirk[62].
Après l'affaire : de nouvelles indications
[modifier | modifier le code]En 1964, Jacob Sheskin (en) découvre l'effet du thalidomide sur la lèpre[63] ; il publie en 1965.
La protection conférée par le brevet arrive à terme en : d'autres firmes peuvent désormais librement produire le thalidomide.
Malgré ce scandale, le thalidomide est apparu dès cette époque comme ayant un potentiel antitumoral. Il a, par la suite, été utilisé dans des maladies graves, en l'absence d'autres options thérapeutiques, notamment contre le myélome ou la maladie de Crohn. Le , une autorisation de mise sur le marché européenne de la molécule a été accordée : elle est utilisée comme médicament orphelin dans le traitement de la lèpre[64] et du lupus érythémateux disséminé (LED) mais sa seule indication retenue en France est dans le traitement des myélomes multiples chez le patient non éligible à l'autogreffe. Il est alors associé à bortézomib (Velcade) et prednisone et permet l'allongement de la durée de vie des patients atteints de ce type de cancer hématologique grave[65].
Le thalidomide serait intéressant dans la cachexie du patient cancéreux[66],[67],[68] du fait de son action anticytokine et anti TNF alpha, ce dernier étant anorexigène. La molécule présente des résultats prometteurs avec la maladie de Rendu-Osler, du fait de ses propriétés immunomodulatrices[69]. Elle serait efficace dans les toux réfractaires lors d'une fibrose pulmonaire idiopathique[70].
En France, sa prescription est limitée à un mois chez les femmes pouvant procréer[71].
Par mesure de sécurité, l'usage vétérinaire du thalidomide — qui peut présenter un intérêt pour le traitement de la péritonite infectieuse féline — a été interdit par la FDA[72].
Mécanismes de l'effet tératogène
[modifier | modifier le code]Il semble induit par la capacité du médicament à inhiber l'angiogenèse[73] — en interférant avec le développement des vaisseaux sanguins du fœtus, surtout en cas de prise au cours des 25 à 50 premiers jours de la grossesse, la molécule ayant un effet d'intercalation dans les molécules d'ADN.
Au niveau moléculaire, le thalidomide se fixe sur une protéine, le celebron (CRBN) qui forme un complexe avec d'autres protéines (DDB1 (en) et CUL4A (en)) intervenant dans la croissance des membres[74]. Un autre mécanisme à l'origine de la malformation des membres induite par la thalidomide est lié à la voie de signalisation NF-κB. La recherche a révélé que des changements dans le microenvironnement redox, déclenchés par la génération de radicaux libres à partir de la thalidomide, conduisent à la suppression de l'expression génique médiée par NF-κB, responsable de la phocomélie [75].
Détails techniques
[modifier | modifier le code]Le thalidomide a pour formule C13H10N2O4 ; phtalimido-glutarimide ; son nom systématique est la 2-(2,6-dioxo-3-pipéridinyl)-1H-isoindole-1,3(2H)-dione. C'est un médicament sédatif et hypnotique.
Cette molécule possède un atome de carbone asymétrique, le C10 qui porte le groupe phtalimido-. Elle est donc dite chirale car elle existe sous deux énantiomères R et S, les formes (–) (lévogyre) et (+)(dextrogyre) n'ayant pas les mêmes effets. La forme R protège contre les nausées et inhibe la production de TNFα (ce qui a pour conséquence son efficacité dans le traitement de certaines tumeurs ou syndrome inflammatoire), l'autre a des effets tératogènes. Néanmoins, les deux formes pouvant potentiellement se convertir l'une en l'autre, comme montré dans une étude humaine in vivo[76],[77], l'effet tératogène n'aurait peut-être pas été évité pour les femmes en n'administrant qu'une seule des deux formes (dépendant des concentrations utilisées).
Des analogues chimiques de la forme lévogyre du thalidomide ont été développés dont le lénalidomide. Ce dernier pourrait avoir l'efficacité de la molécule mère avec un profil toxique cependant différent[78].
Téléfilms et documentaires
[modifier | modifier le code]- Un seul comprimé [Ein einzige Tablette], téléfilm allemand en deux parties d'Adolf Winkelmann, est une fiction réalisée en 2006 sur la tragédie de la prescription de thalidomide ; elle met en scène le combat d'une de ses victimes. Le fabricant du thalidomide a contesté en justice la diffusion de ce téléfilm, mais n'a obtenu que des modifications mineures et la première diffusion a eu lieu en [79].
- Effets secondaires, téléfilm allemand en deux parties sorti en 2006[80]. Diffusé sur Arte le .
- Nobody's Perfect, documentaire de Niko von Glasow[81].
- Futur handicapé, documentaire de Werner Herzog.
- Call the Midwife, saisons 5 et 6 (épisode 7 notamment), sur l'utilisation de la molécule pour ses effets sédatifs et anti-nauséeux en particulier chez la femme enceinte, et les conséquences sur le développement in-utero.
- Attacking the Devil - Harold Evans and the last Nazi crime, documentaire de Jacqui et David Morris, diffusé en sur le travail d'investigation du redacteur en chef du Sunday Times.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) ChemIDplus, « Thalidomide - RN: 50-35-1 », sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine (consulté le ).
- La forme féminine est plus courante, et utilisée dans plusieurs dictionnaires, mais le Vidal indique le masculin, comme pour tous les principes actifs se terminant en -ide.
- « Orphanet: Embryopathie à la thalidomide », sur www.orpha.net (consulté le )
- Dès 1962, l'OMS pousse à l'édification d'un programme mondial de pharmacovigilance. Les États-Unis assurent d'abord cette fonction de 1968 à 1970 avec leur centre basé à Alexandria en Virginie ; l'OMS crée en 1971 le WHO Drug Monitoring Centre à Genève puis le WHO Collaborating Centre for International Drug Monitoring en 1978 à Uppsala.
- En 2009, la presse s'est fait l'écho d'un article du Dr Martin Johnson, directeur du Thalidomide Trust où est formulée l'hypothèse que Grünenthal aurait acheté sinon le brevet sur la substance elle-même, du moins le nom « Contergan » à… Rhône Poulenc, cf. (en) Daniel Foggo « Thalidomide 'was created by the Nazis' » The Sunday Times February 8, 2009 http://www.timesonline.co.uk/tol/life_and_style/health/article5683577.ece.
- Filiale de Grünenthal Pharma Gmbh & Co. Kg.- propriété de la famille Wirtz, Chemie Grünenthal Gmbh fut fondé à Stolberg en 1946.
- (en) Walter Sneader « Drug discovery: a history » John Wiley and Sons, 2005.
- Jérôme Janicki, Le drame de la thalidomide : un médicament sans frontières, 1956-2009, L'Harmattan, , 280 p. (lire en ligne), p. 142.
- Les effets tératogènes du thalidomide furent en effet testés sur des rates gravides. Or les rongeurs ne sont pas sensibles à ce médicament, car les métabolites synthétisés sont différents entre les rongeurs et les autres mammifères (des tests plus récents ont mis en évidence l'action tératogène chez la lapine).
- (en) W. Kunz, H.Keller, H. Muckter « N-Phtalyl-Glutaminic Imide » Arzneimittelforschung / Drug Research 1956;6(8):426-430, d'après .
- (en) W. Lenz « A short history of thalidomide embryopathy ».
- (en) P. Nicolopoulou-Stamati, Luc Hens, C. V. Howard « Congenital diseases and the environment » Springer, 2007 ; d'autres sources précisent novembre 1956 en indiquant la région d'introduction : Hambourg.
- (en) [PDF] « http://leda.law.harvard.edu/leda/data/351/Lutz.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ).
- (en) The Sunday Times, « An end to the terrible saga of thalidomide ».
- Au Japon, le laboratoire Dai-Nippon Seiyaku/Dai Nippon Pharmaceutical commercialisa le 20 janvier 1958 le somnifère Isomin et en 1959 une spécialité pour les maux d'estomac, Proban M. En septembre 1958 Pharmacolor AG le distribuait en Suisse ? Au Brésil, au Danemark en Finlande, en Irlande, aux Pays-Bas, en Norvège, en Suède il fut commercialisé en 1959 - en Suède Astra AB (en) lança le Neurosedyn en février 1959. En Belgique, il fut commercialisé sous le nom de Softenon, dès 1959. En Australie, en Italie et au Portugal il fut commercialisé en 1960 ; au Canada ce fut (des échantillons avaient été distribués dès 1959). Deux sociétés se partageaient le marché canadien : Frank W.Horner Ltd. (Talimol) et la filiale canadienne de Merrell (Kevadon).
- mélangé à l'aspirine, la phénacétine, l'amidopyrine, la bacitracine, la Dihydrostreptomycine, et même au Sécobarbital, il fut commercialisé en Allemagne sous les appellations : Algosediv, Enterosediv, Grippex, Prednisediv, Nectosediv, Poly-Gripan et Peracon-Expectorans cf.(de) Henning Sjöström, Robert Nilsson « Contergan oder die Macht der Arzneimittelkonzerne » VEB Vlg Volk und Gesundheit, 1975. Ailleurs on trouvait Asmaval pour l'asthme, Tensival pour l'hypertension, Valgraine pour la migraine.
- Escoffier-Lambiotte, « II - La carence de l'information médicale et la prolifération des médicaments », Le Monde, .
- (en) Bette Overell « Animal research takes lives: humans and animals both suffer ». Cette indication pour les femmes enceintes se prévalait d'une étude du Dr Blasiu… qui a ultérieurement catégoriquement nié avoir jamais émis cette recommandation.
- Claude Monneret, Claude Bohuon « Fabuleux hasards : histoire de la découverte de médicaments ».
- Dr Bernard Dixon, New Scientist, ,Vol. 56, No 814.
- Le Spiegel du 3 juin 1968, qui donne le 27 juillet, apporte un éclairage précieux sur cette obligation de prescription.
- Le Spiegel du 22 avril 1968 rapporte que ce précédent article référençait les effets secondaires observés dès 1959.
- Weidemann, H-R. Med Welt. 37. 1961.
- Roland Delcour, « Le procès de la thalidomide, menace de tourner court », Le Monde, .
- (en) [PDF] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2019423/pdf/archdisch01575-0044.pdf.
- Jérôme Janicki, Le drame de la thalidomide: un médicament sans frontières, 1956-2009.
- Mis au courant de l'existence de cet article, Grünenthal a tenté d'en empêcher la parution cf. Jérôme Janicki Le drame de la thalidomide: un médicament sans frontières, 1956-2009.
- Préoccupé par l’accroissement du nombre d'enfants malformés, le Dr Lenz qui avait songé à plusieurs causes étiologiques, comme la retombée de substances radioactives, ne commença à pressentir le rôle du thalidomide qu'à partir du cf. Jérôme Janicki Le drame de la thalidomide : un médicament sans frontières, 1956-2009 Éditions L'Harmattan, 2009. Il avait également écarté l'hypothèse d'une variation du Syndrome de Holt-Oram http://ci.nii.ac.jp/els/110002788527.pdf?id=ART0003143917&type=pdf&lang=en&host=cinii&order_no=&ppv_type=0&lang_sw=&no=1317538901&cp=.
- « Missgeburten durch Tabletten? - Alarmierender Verdacht eines Arztes gegen ein weitverbreitetes Medikament ».
- « L'enquête menée par la justice allemande sera longue car la firme productrice du Contergan rejette toute responsabilité », Le Monde, .
- Japanese Teratology Society, le dernier enfant japonais porteur d'un handicap causé par le thalidomide est même né en 1965.
- http://www.thalidomide.org/web/japan-1/.
- http://www.senate.be/www/?MIval=/publications/viewPub&COLL=S&LEG=4&NR=1683&PUID=67111689&LANG=fr.
- (en) Arthur A. Daemmrich Pharmacopolitics: drug regulation in the United States and Germany UNC Press Books, 2004.
- (en) Adriana Petryna, When experiments travel:clinical trials and the global search for human subjects, Princeton University Press, 2009.
- (en) Carl Elliott, White Coat, Black Hat: Adventures on the Dark Side of Medicine.
- « Thalidomide - Produits SCF », sur Société Chimique de France (SCF) (consulté le )
- (de) « Contergan-Skandal : Auch in der DDR gab es Kinder mit Missbildungen », sur Mitteldeutsche Zeitung, (consulté le ).
- (de) Klaus Huhn, Mord durch Tablette. Der Fall Contergan, automne 2011.
- (de) Von Silvia Ottow, « DDR-Bürger schliefen ohne Contergan » Neues Deutschland, .
- Escoffier-Lambiotte, « Un sédatif d'origine allemande, vendu dans divers pays est responsable de milliers de malformations congénitales », Le Monde, (lire en ligne).
- (en) Elisabeth A. Cawthon Medicine on trial: a handbook with cases, laws, and documents ABC-CLIO, 2004.
- Hermann Wirtz, Heinrich Mückter, Jacob Chauvistré, Hermann Josef Leufgens, Klaus Winandi, Gotthold Erich Werner, Günter Sievers, Heinz Wolfgang Kelling, et Hans Werner von Schrader- Beielstein.
- (de) Der Spiegel, « das problem des erlaubten risikos », .
- http://www.thalidomide.ca/filesNVIAdmin/File/TexteEucher.pdf.
- Patrick Berche et Jean-Jacques Lefrère, Gloires et impostures de la médecine, Perrin, , 280 p..
- Olivier Pastré, L’économie en question sur France Culture, 2 avril 2011.
- http://www.conterganstiftung.de/stiftung/index.htm.
- « The Times & The Sunday Times », sur timesonline.co.uk (consulté le ).
- https://publications.parliament.uk/pa/cm200910/cmhansrd/cm100114/debtext/100114-0006.htm#10011456000006.
- Claude Monneret, Claude Bohuon, Fabuleux hasards : histoire de la découverte de médicaments.
- [1]
- (en) Adriana Petryna, When experiments travel:clinical trials and the global search for human subjects, Princeton University Press, 2009.
- Scientists and the Regulation of Risk: Standardising Control Par David Demortain.
- « A Communication from the International Clearinghouse for Birth Defects Monitoring System », sur Oxfordjournals.org, (consulté le ).
- Christian Bonah, « Pourquoi l’industrie automobile n’a pas inventé la bioéthique ? », L'Atelier du Centre de recherches historiques, .
- http://www.penroseinquiry.org.uk/preliminary-report/chapter-12/.
- (en) Elisabeth A. Cawthon Medicine on trial: a handbook with cases, laws, and documents ABC-CLIO, 2004, où l'auteur relate l'intervention de la Cour Européenne des Droits de l'Homme.
- Cette affaire, révélée par la presse belge le , eu un grand retentissement international : aidée d'un médecin, une femme et son mari avaient empoisonné leur nouveau-né victime de la thalidomide. Après des mois d'instruction, le procès qui s'ouvrit le déboucha sur un acquittement général. On peut lire en ligne une description de l'affaire dans : Haquin-Stephany, Les grands dossiers criminels en Belgique, Volume 1, Lannoo Uitgeverij, 2005.
- Paul Benkimoun, « La thalidomide : un scandale qui a renforcé la pharmacovigilance », Le Monde, .
- http://www.springerlink.com/content/k25h8j520l40n015/.
- Franck Nouchi, « Médecine. Le retour d'un médicament banni La thalidomide guérit la réaction lépreuse », Le Monde, .
- (en) Sheskin J, « Thalidomide in the treatment of lepra reactions », Clin Pharmacol Ther., 1965;6:303.
- (en) Singhal S, Mehta J, Desikan R et al, Antitumor activity of thalidomide in refractory multiple myeloma, N Engl J Med, 1999;341:1565.
- (en) Gordon et al., « Thalidomide in the treatment of cancer cachexia: a randomised placebo controlled trial », Gut, vol. 54, , p. 540-45.
- Khan et al., « Oesophageal cancer and cachexia: the effect of short-term treatment with thalidomide on weight loss and lean body mass », Aliment Pharmacol Ther, vol. 17, , p. 677-82.
- Wilkes et al., « Thalidomide: an effective anabolic agent in gastrointestinal cancer cachexia », Aliment Pharmacol Ther, vol. 23, , p. 445-46.
- Franck Lebrin et al., « Thalidomide stimulates vessel maturation and reduces epistaxis in individuals with hereditary hemorrhagic telangiectasia », Nat. Med., .
- Horton MR, Santopietro V, Mathew L et al. Thalidomide for the treatment of cough in idiopathic pulmonary fibrosis: A randomized trial, Ann Intern Med, 2012;157:398-406.
- Arrêté du (JO du ).
- « http://www.avma.org/onlnews/javma/feb03/030201e.asp »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ).
- (en) D’Amato RJ, Loughnan MS, Flynn E, Folkman J, Thalidomide is an inhibitor of angiogenesis, Proc Natl Acad Sci U.S.A. 1994;91:4082.
- (en) Ito T, Ando H, Suzuki T et al. Identification of a primary target of thalidomide teratogenicity, Science, 2010;327:1345-1350.
- (en) Jason M. Hansen et Craig Harris, « A Novel Hypothesis for Thalidomide-Induced Limb Teratogenesis: Redox Misregulation of the NF-κB Pathway », Antioxidants & Redox Signaling, vol. 6, no 1, , p. 1–14 (ISSN 1523-0864 et 1557-7716, DOI 10.1089/152308604771978291, lire en ligne, consulté le ).
- (en) Teo SK, Colburn WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD, Laskin OL, « Clinical pharmacokinetics of thalidomide », Clin Pharmacokinet, vol. 43, no 5, , p. 311–327 (PMID 15080764, DOI 10.2165/00003088-200443050-00004).
- Eriksson T, Björkman S, Roth B, Fyge A, Höglund P, Stereospecific determination, chiral inversion in vitro and pharmacokinetics in humans of the enantiomers of thalidomide, Chirality, 1995;7:44-52.
- (en) AF List, « Lenalidomide — The Phoenix Rises », New Eng J Med, vol. 357, , p. 2183-2186 (lire en ligne).
- Lorraine Rossignol, « La thalidomide continue de faire scandale en Allemagne », Le Monde, (lire en ligne).
- http://www.programme-tv.net/programme/divertissement/r14897-effets-secondaires/1236094-effets-secondaires/.
- http://www.nobodysperfect-film.de/en/trailer.html.
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Thomas Quasthoff
- Pierre Marois
- Martin Staemmler
- Frances Oldham Kelsey
- Lénalidomide
- Neuropathie
- Otto Ambros fut un des administrateurs de Chemie Grünenthal pendant les années 1961 - 1962.
- Antiémétique
- Syndrome de Roberts ou syndrome pseudoThalidomide
- Médicaments et grossesse
- Jean Mottard
- Responsabilité du fait des produits de santé défectueux
Liens externes
[modifier | modifier le code]- (en + de) Thalidomide - Liste annotée de Liens
- Association canadienne des victimes de la thalidomide
- Dossier sur la thalidomide aux archives de Radio-Canada
- Émission de Radio Canada du animée par Fernand Seguin « Le secret entourant la Thalidomide »
- (en) Site de Tom Yendell, artiste qui peint avec la bouche ou les pieds
- International Clearinghouse for Birth Defects Monitoring Systems
- Produit chimique toxique
- Produit chimique mutagène
- Produit chimique reprotoxique
- Tératogène
- Médicament orphelin
- Phtalimide
- Glutarimide
- Invention allemande
- Affaire ou scandale sanitaire
- Gestion des risques majeurs
- Santé
- Sociologie de la santé
- Traitement médical
- Politique de sécurité
- Santé publique
- Médicament retiré du marché
- Risque sanitaire
- Catastrophe sanitaire en 1961
- Catastrophe sanitaire en Allemagne

