Tionitronio
| Ione tionitronio | |
|---|---|
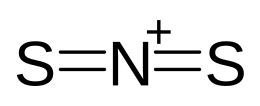 | |
| Nome IUPAC | |
| bis(solfaniliden)azanio | |
| Nomi alternativi | |
| ione ditionitronio ione tionitronio ione ditionitroile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | NS2⁺ |
| Massa molecolare (u) | 78,137 |
| Numero CAS | |
| Numero EINECS | --- |
| PubChem | --- |
| SMILES | S=N[S+] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |

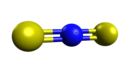
Il ditionitronio,[1][2][3][4] nome sistematico: bis(solfaniliden)azanio,[5] detto a volte anche ditionitroile[6] o anche tionitronio,[7] è un catione molecolare lineare dell'azoto pentavalente con lo zolfo, avente formula chimica NS2+ o anche, in formula semistrutturale, [S=N=S]+, da cui sivede l'analogia con lo ione nitronio [O=N=O]+, del quale il ditionitronio è isoelettronico di valenza.[8]
La corrispondente specie neutra è il radicale libero (NS2)•, isoelettronico con il biossido di azoto;[9] la corrispondente specie anionica è lo ione ditionitrito [S=N−S− ↔ −S−N=S], isoelettronico con lo ione nitrito.[8]
Si tratta di uno ione stabile in composti di tipo salino, quali (NS2)SbCl6, (NS2)AsF6, (NS2)AlCl4 ed altri.
Sintesi
[modifica | modifica wikitesto]Fu sintetizzato per la prima volta da Ronald Gillespie e collaboratori come sale dell'anione esafluoroantimoniato, (NS2)SbCl6.[7]
S7NH + BCl3 S7NBCl2
S7NBCl2 + SbCl5 (S2N)SbCl6
Metodi di sintesi più recenti del ditionitronio sono schematizzabili come segue:[10]
3/8 S8 + S3N3Cl3 + 3 AgSbF6 → 3 (S2N)SbF6 + 3 AgCl
1/8 S8 + [S3N2Cl]Cl + 2 AgSbF6 → 2 (S2N)SbF6 + 2 AgCl
Proprietà e struttura
[modifica | modifica wikitesto]Il catione ditionitronio è uno ione molecolare triatomico lineare, con simmetria molecolare D∞h. Lo ione è descritto come un ibrido di risonanza tra tre forme limite principali in cui tutti gli atomi hanno l'ottetto:
S=N+=S ↔ −S−N+≡S+ ↔ +S≡N+−S−
In tutte e tre queste forme l'atomo di azoto porta su di sé una carica positiva formale, mentre ciascun atomo di zolfo solo una volta su tre. Tuttavia, le cariche parziali stimate da calcoli semiempirici sono q(N) ≈ -0,33 e e q(S) ≈ +0,67 e.[3] A tal proposito, ed anche tenendo conto del fatto che N è più elettronegativo di S (3,04 > 2,58[11]), sono state suggerite altre due forme di risonanza con S positivo e privo dell'ottetto:[3]
+S−N=S ↔ S=N−S+
Calcoli quantomeccanici a livello MPW1PW91/6-31G(d) confermano che la carica sullo zolfo è positiva e la pongono pari a q(S) ≈ +0,86 e, il che comporta che q(N) ≈ -0,72 e.[12]
Struttura cristallina
[modifica | modifica wikitesto]Di questo catione sono stati ottenuti i composti salini con i controioni SbF6−, SbCl6−, AsF6− e AlCl4−, FeCl4−, CF3SO3−.[7][12]
L'esafluoroantimoniato di ditionitronio a temperatura ambiente è un solido giallo chiaro avente densità di 3,019 g/cm³; si può ottenere in forma cristallina per lenta evaporazione di una sua soluzione in anidride solforosa liquida. In tal modo, NS2SbF6 cristallizza nel sistema monoclino, gruppo spaziale C2/m con a = 974,0(2) pm, b = 664,4(2) pm, c = 533,4(1) pm, β = 90,58(2)°; la cella elementare contiene 2 unità formula. La sua entalpia di formazione standard stimata è ΔHƒ° = -1.566 ± 24 kJ/mol.[12]
La distanza N-S risulta pari a 148,74 pm. Quella nell'analogo composto con l'esafluoroarseniato (NS2AsF6), che è isomorfo, è praticamente uguale, 148,0 pm.[12]
Analoghi
[modifica | modifica wikitesto]Si conoscono diversi cationi contenenti sia azoto che zolfo. Il più importante è il tionitrosonio (NS+) analogo solforato del nitrosonio, ma se ne conoscono altri più esotici quali S3N2+, S4N42+, S5N5+, S6N42+, (S2N2)2N+ e diversi analoghi contenenti selenio come SeS2N2+, Se2SN22+ e Se3N22+.[7]
Note
[modifica | modifica wikitesto]- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, pp. 561-563, ISBN 0-7506-3365-4.
- ^ Romolo Faggiani, Ronald J. Gillespie e Colin J. L. Lock, Preparation, vibrational spectra, and crystal structure of dithionitronium hexachloroantimonate(V), (S2N)(SbCl6), in Inorganic Chemistry, vol. 17, n. 11, 1º novembre 1978, pp. 2975–2978, DOI:10.1021/ic50189a002. URL consultato il 3 dicembre 2024.
- ^ a b c I. Silaghi-dumitrescu e I. Haiduc, Electronic structure and force constants of the dithionitronium cation NS2+, in Journal of Molecular Structure: THEOCHEM, vol. 106, n. 3, 1º gennaio1984, pp. 217–223, DOI:10.1016/0166-1280(84)85025-3. URL consultato il 3 dicembre 2024.
- ^ Max Herberhold, 1º maggio 1988, DOI:10.1080/02603598808072300, https://www.tandfonline.com/doi/abs/10.1080/02603598808072300. URL consultato il 3 dicembre 2024.
- ^ (EN) PubChem, Bis(sulfanylidene)azanium, su pubchem.ncbi.nlm.nih.gov. URL consultato il 3 dicembre 2024.
- ^ (EN) J. P. Johnson, J. Passmore e P. S. White, Structure of dithionitryl hexafluoroarsenate(V), in Acta Crystallographica Section C: Crystal Structure Communications, vol. 43, n. 9, 15 settembre 1987, pp. 1651–1653, DOI:10.1107/S0108270187090681. URL consultato il 3 dicembre 2024.
- ^ a b c d (EN) George A. Olah, G. K. Surya Prakash e Jean Sommer, Superacid Chemistry, John Wiley & Sons, 26 marzo 2009, ISBN 978-0-470-42154-3. URL consultato il 3 dicembre 2024.
- ^ a b Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 685, ISBN 978-3-11-026932-1.
- ^ Uzi Kaldor, Symmetry breaking in radicals: NO2, NS2 and NO3, in Chemical Physics Letters, vol. 185, n. 1, 11 ottobre 1991, pp. 131–135, DOI:10.1016/0009-2614(91)80153-O. URL consultato il 3 dicembre 2024.
- ^ Catherine E. Housecroft e Alan G. Sharpe, Inorganic chemistry, 3. ed, Pearson Prentice Hall, 2008, p. 528, ISBN 978-0-13-175553-6.
- ^ A. L. Allred, Electronegativity values from thermochemical data, in Journal of Inorganic and Nuclear Chemistry, vol. 17, n. 3, 1º giugno 1961, pp. 215–221, DOI:10.1016/0022-1902(61)80142-5. URL consultato il 3 dicembre 2024.
- ^ a b c d T. Stanley Cameron, Aaron Mailman e Jack Passmore, Convenient Preparation and Full Characterization of a Synthetically Useful Salt of the Dithianitronium Cation, SNSSbF6, from Readily Available Starting Materials, in Inorganic Chemistry, vol. 44, n. 19, 1º settembre 2005, pp. 6524–6528, DOI:10.1021/ic0483139. URL consultato il 3 dicembre 2024.
Bibliografia
[modifica | modifica wikitesto]- George A. Olah, G.K. Surya Prakash, Jean Sommer, Árpád Molnár Superacid Chemistry, 2009, ISBN 978-0-471-59668-4
- Tristram Chivers, A Guide to Chalcogen-Nitrogen Chemistry, World Scientific Publishing Co. Pte. Ltd., 2005, ISBN 981-256-095-5.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Tionitronio
Wikimedia Commons contiene immagini o altri file su Tionitronio