Trichlooretheen
| Trichlooretheen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
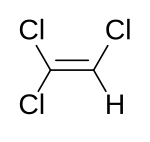
| ||||
Structuurformule van trichlooretheen
| ||||
| Algemeen | ||||
| Molecuulformule | C2HCl3 | |||
| IUPAC-naam | 1,1,2-trichlooretheen | |||
| Andere namen | trichloorethyleen, 1,1,2-trichlooretheen, triklone, Triklone N, Tri | |||
| Molmassa | 131,38834 g/mol | |||
| SMILES | ClC=C(Cl)Cl
| |||
| InChI | 1/C2HCl3/c3-1-2(4)5/h1H
| |||
| CAS-nummer | 79-01-6 | |||
| EG-nummer | 201-167-4 | |||
| PubChem | 6575 | |||
| Wikidata | Q407936 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H336 - H341 - H350 - H412 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P201 - P261 - P273 - P281 - P305+P351+P338 - P308+P313 | |||
| Carcinogeen | ja (Categorie 1) | |||
| Omgang | Draag veiligheidshandschoenen, uitsluitend te gebruiken in een goed geventileerde ruimte. | |||
| Opslag | In een koele, goed geventileerde en donkere plaats. | |||
| EG-Index-nummer | 602-027-00-9 | |||
| VN-nummer | 1710 | |||
| ADR-klasse | Gevarenklasse 6.1 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,46[1] g/cm³ | |||
| Smeltpunt | −86[1] °C | |||
| Kookpunt | 87[1] °C | |||
| Zelfontbrandings- temperatuur | 410[1] °C | |||
| Dampdruk | 78 × 102[1] Pa | |||
| Oplosbaarheid in water | 1[1] g/L | |||
| Goed oplosbaar in | methanol, ethanol, 2-propanol, aceton, ether, benzeen, dichloormethaan, dimethylformamide, azijnzuur, chloroform | |||
| Slecht oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 0,36 D | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Trichlooretheen, trichloorethyleen, of tri is een giftig oplosmiddel met als brutoformule C2HCl3. Het is een kleurloze, niet ontvlambare, vluchtige vloeistof met een karakteristieke geur die lijkt op die van chloroform.
Productie
[bewerken | brontekst bewerken]Er zijn verschillende syntheseroutes mogelijk voor de bereiding van trichlooretheen, onder meer:
- de katalytische hydrogenering van tetrachlooretheen in de gasfase bij temperaturen tot 250 °C, met gebruik van een koper-palladium-katalysator op een dragermateriaal:
- 1,2-dichlooretheen, gevormd door de chlorering van etheen, kan verder gechloreerd worden tot trichlooretheen, bij 280 tot 450 °C en met behulp van een katalysator zoals kalium- of aluminiumchloride of actieve kool:
De productie in de Europese Unie werd geschat op 138.000 ton per jaar in 1996.[2]
Toepassingen
[bewerken | brontekst bewerken]De voornaamste toepassing is voor het reinigen, meer bepaald het ontvetten bij hoge temperatuur in de dampfase, van metalen oppervlakken. Verder wordt het gebruikt als oplosmiddel in kleefstoffen en andere producten. Trichlooretheen wordt verwerkt in kleefstoffen omdat het niet ontvlambaar, maar wel vluchtig is.
Het is ook een intermediair product in de synthese van andere chemicaliën, zoals HFC 134a (1,1,1,2-tetrafluorethaan), een koelmiddel dat gebruikt wordt als alternatief voor cfk's (chloorfluorkoolstofverbindingen) die niet meer mogen gebruikt worden volgens het Montréal-protocol. In de metallurgie wordt het gebruikt als extractievloeistof.
Trichlooretheen werd vroeger door stomerijen gebruikt als reinigingsmiddel, maar voor deze toepassing is het vervangen door tetrachlooretheen. Het is gebruikt voor het oplossen van vlekken in tapijt en kleding (hiervoor stond het bekend als "tri"). Tegenwoordig is de verkoop aan particulieren verboden. Trichlooretheen werd vroeger ook gebruikt als anesthesiegas, vooraleer men de schadelijke eigenschappen van de stof kende.
Het gebruik van trichlooretheen in de Europese Unie is met meer dan de helft gedaald tussen de jaren 1970 en 2000,[2] dankzij verbeterde technieken voor de recuperatie van het oplosmiddel en het gebruik van alternatieve oplosmiddelen.
Regelgeving
[bewerken | brontekst bewerken]In de Europese Unie beveelt het Wetenschappelijk Comité inzake grenswaarden voor beroepsmatige blootstelling op de arbeidsplaats (SCOEL) een blootstellingslimiet voor werknemers blootgesteld aan trichlooretheen van 10 ppm (54,7 mg/m³) voor 8-uur TWA en van 30 ppm (164,1 mg/m³) voor STEL (15 minuten).[3]
De bestaande EU-wetgeving ter bescherming van werknemers tegen gevaren van blootstelling aan carcinogene of mutagene stoffen (namelijk de Chemische Agentia Richtlijn 98/24/EG[4] en de Carcinogene Agentia Richtlijn 2004/37/EG[5]) bepaalt op dit moment geen bindende minimumeisen voor de controle van gezondheidsrisico's voor werknemers tijdens de gebruiksfase of gedurende de gehele levenscyclus van trichlooretheen. De lopende besprekingen onder de Carcinogene Agentia Richtlijn zal resulteren in het instellen van een bindend beroepsmatige blootstelling aan trichlooretheen voor de bescherming van de werknemers, en dan kan deze conclusie worden herzien.
De Oplosmiddelen Emissies Richtlijn 1999/13/EG[6] en de richtlijn inzake industriële emissies 2010/75/EU[7] bepalen bindende minimumeisen voor de uitstoot van trichlooretheen in het milieu voor bepaalde activiteiten, met inbegrip van oppervlaktereiniging. Echter komen de activiteiten met verbruik van oplosmiddelen onder een bepaalde drempelwaarde niet onder deze minimale eisen.
Volgens de Europese regelgeving wordt het gebruik van trichlooretheen verboden voor individuen in een concentratie van meer dan 0,1%. In de industrie moest trichlooretheen worden vervangen voor 21 april 2016 (tenzij een vrijstelling werd verzocht voor 21 oktober 2014)[8] door andere producten zoals tetrachlooretheen (perchlooretheen), dichloormethaan, of andere verbindingen (ketonen, alcoholen).
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Trichlooretheen is niet ontvlambaar, maar in een brand ontbindt het met vorming van giftige en corrosieve dampen (chloor, fosgeen, zoutzuur). Het is een kankerverwekkende (categorie 1) en mogelijk mutagene (categorie 3) stof. De stof is irriterend voor huid en slijmvliezen en kan effecten hebben op de lever, de nieren en het centrale zenuwstelsel, met als symptomen onder meer hoesten, buikkrampen, misselijkheid, braken en bewusteloosheid. Enkele dagen na blootstelling aan hoge doses worden delen van het gelaat en de tong gevoelloos door aantasting van de zenuwen.
Blootstelling aan een hoge concentratie van trichlooretheendamp kan een acute vergiftiging, coma of zelfs de dood veroorzaken. Langdurig of herhaaldelijk contact met de huid kan de huid overgevoelig maken en een eczeemachtige aandoening veroorzaken. In de jaren 70 en 80 van de 20e eeuw werd het als roesmiddel gesnoven.
Alleen al in de Verenigde Staten zijn 29 schandalen bekend waarin geloosd of gedumpt industrieel trichlooretheen het grondwater heeft bereikt. In een aantal gevallen leidde dit tot gezondheidsproblemen en sterfte bij de bevolking die hieruit drinkwater consumeerde.
Een onderzoek uit 2023 concludeert dat blootstelling aan trichlooretheen een hoger risico op de ziekte van Parkinson oplevert.[9]
Externe links
[bewerken | brontekst bewerken] trichlooretheen - International Chemical Safety Card
trichlooretheen - International Chemical Safety Card- Gegevens van trichlooretheen in het European Chemical Substances Information System (ESIS)
- (en) Risk Assessment Report trichloroethylene (European Chemicals Bureau, 2004)
- (en) Duurzaam gebruik en aanbevelingen van Industrie
- ↑ a b c d e f (en) Gegevens van trichlooretheen in de GESTIS-stoffendatabank van het IFA (geraadpleegd op 09 december 2008)
- ↑ a b Risk Assessment Report trichloroethylene (European Chemicals Bureau, 2004)
- ↑ SCOEL/SUM/142, April 2009
- ↑ Richtlijn 98/24/EG
- ↑ Richtlijn 2004/37/EG
- ↑ Richtlijn 1999/13/EG
- ↑ Richtlijn 2010/75/EU
- ↑ Verordening (EU) nr. 348/2013 van de Commissie van 17 april 2013 tot wijziging van bijlage XIV bij Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen („REACH”)
- ↑ (en) Goldman SM, Weaver FM, Stroupe KT, et al. (15 mei 2023). Risk of Parkinson Disease Among Service Members at Marine Corps Base Camp Lejeune.. JAMA Neurology. DOI: 10.1001/jamaneurol.2023.1168. Geraadpleegd op 16 mei 2023.




