Ubiquitine
| Ubiquitine | ||
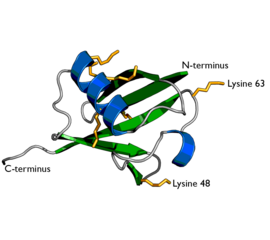 Représentation de l'ubiquitine, montrant les chaînes latérales de lysine en jaune orangé (PDB 1UBI). | ||
| Caractéristiques générales | ||
|---|---|---|
| Fonction | protéine multifonctionnelle | |
| Distribution | tous les eucaryotes | |
| Localisation | ubiquitaire | |
| Classification | ||
| Pfam | PF00240 | |
| InterPro | IPR000626 | |
| PROSITE | PDOC00271 | |
| SCOP | 1aar | |
| SUPERFAMILY | 1aar | |
| Gène UBB — Polyubiquitine B | ||
| Homo sapiens | ||
| Locus | 17p11.2 | |
| Masse moléculaire | 25 762 Da[1] | |
| Nombre de résidus | 229 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène UBC — Polyubiquitine C | ||
| Homo sapiens | ||
| Locus | 12q24.31 | |
| Masse moléculaire | 77 039 Da[1] | |
| Nombre de résidus | 685 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène UBA52 Ubiquitine-Protéine L40 du ribosome 60S | ||
| Homo sapiens | ||
| Locus | 19p13.11 | |
| Masse moléculaire | 14 728 Da[1] | |
| Nombre de résidus | 128 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène RPS27A Ubiquitine-Protéine S27a du ribosome 40S | ||
| Homo sapiens | ||
| Locus | 2p16.1 | |
| Masse moléculaire | 17 965 Da[1] | |
| Nombre de résidus | 156 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
L'ubiquitine est une protéine de 76 acides aminés servant, elle-même, de marqueur de protéines à éliminer. Elle est ainsi appelée parce qu'elle est localisée dans tous les compartiments subcellulaires de toutes les cellules des organismes, elle est dite ubiquitaire. L'ubiquitination désigne la fixation (covalente, ATP dépendante grâce à une cascade d'enzymes E1, E2, E3) spécifique et régulée d'une ou plusieurs ubiquitines sur une protéine cible (il faut quatre ubiquitines pour qu'une protéine soit dégradée). Cette modification post-traductionnelle a pour principale fonction la reconnaissance puis la destruction de la protéine ainsi marquée, par le complexe protéolytique du protéasome.
Structure
[modifier | modifier le code]
L'ubiquitine comporte 76 acides aminés et a une masse moléculaire d'environ 8 500 Da. Elle possède une glycine à son extrémité C-terminale lui permettant de former une liaison thiol-ester avec E1. Sa structure est très conservée parmi les différentes espèces d'eucaryotes : l'ubiquitine humaine et celle d'une levure partagent 96 % d'identité pour leur séquence protéique[2].
Mécanisme d'action
[modifier | modifier le code]Il existe trois systèmes de protéolyse (destruction des protéines) :
- une destruction par des enzymes (protéases) digestives non spécifiques : trypsine, pepsine, chymotrypsine des protides alimentaires ;
- le système lysosomial, non spécifique, permettant la dégradation et le recyclage des protéines cellulaires par des protéases intracellulaires ;
- le système ubiquitine-protéasome, toujours intracellulaire, mais peu spécifique (car ce sont les ubiquitines qui sont reconnues et non la protéine) par un système de marquage des protéines à dégrader.
L'ubiquitine est une petite protéine présente dans toutes les cellules des eucaryotes. Sa fonction principale est de marquer d'autres protéines en vue de leur protéolyse. Plusieurs molécules d'ubiquitine sont liées de façon covalente à la protéine cible (polyubiquitination), grâce à l'action de trois enzymes, E1, E2 et E3-ligases. La protéine ainsi modifiée est ensuite dirigée vers un protéasome, une structure en forme de baril dont l'activité est régulée par l'ubiquitine, et dans laquelle la protéolyse se déroule. L'ubiquitine est alors libérée de son substrat et peut être réutilisée.
Action séquentielle des enzymes permettant la fixation à d'autres protéines :
- Activation : carboxylation terminale de l'ubiquitine par l'enzyme activatrice E1
- Conjugaison : transfert de la molécule activée d'ubiquitine sur un groupe sulfure de l'enzyme conjugante E2.
- Transfert : transfert de la molécule d'ubiquitine via une ubiquitine-ligase E3 à un groupe amyle d'une lysine acceptrice de la protéine à dégrader. Cette protéine s'était auparavant liée à la ligase.
Ce processus peut se répéter de nombreuses fois jusqu'à former un polymère. Il faut au moins quatre molécules d'ubiquitine fixée à la protéine pour que celle-ci soit adressée au protéasome et dégradée.
E1 fixe l'ubiquitine; E1-Ubiquitine se fixe sur E2 puis transfère l'ubiquitine sur E2; E2-Ubiquitine se fixe sur E3. Le complexe E3-E2-Ubiquitine est actif.
E1 (enzyme d'activation de l'ubiquitine) serait unique. Il existerait près d'une centaine de types d'E2 (enzyme de conjugaison d'ubiquitine) et plus de 1000 types d'E3 (ligase ubiquitine-protéine), cette dernière expliquant la spécificité de la réaction. E2 et E3 sont souvent associées l'une à l'autre dans le cytoplasme.
L'ubiquitine peut également marquer des protéines transmembranaires (par exemple, des récepteurs) pour les ôter de la membrane.
Historique
[modifier | modifier le code]En 2004, Aaron Ciechanover, Avram Hershko et Irwin Rose reçurent le Prix Nobel de chimie pour leurs travaux sur la dégradation des protéines contrôlée par l'ubiquitine.
Maladies impliquant l'ubiquitine
[modifier | modifier le code]- Le syndrome de Liddle est une maladie rare décrite pour la première fois en 1960 par Grant Liddle et caractérisée par une hypertension artérielle grave. Une des causes de la maladie parmi d'autres est une mutation d'un gène codant une des sous-unités du canal sodique ENaC, qui empêche la fixation de l'enzyme E3 spécifique appelée NEDD4 et ainsi la dégradation d'ENaC[3].
- La maladie de Parkinson pourrait être également causée par l'accumulation de certaines substances secondaires à un déficit en certains enzymes E3[4].
- Certains cancers pourraient être provoqués par une dégradation excessive de protéines inhibitrices, ou par une accumulation d'autres protides en raison de modification de l'enzyme E3.
- Le système ubiquitine-protéasome aurait également un rôle lors de certaines infections virales.
- Le Syndrome VEXAS (l'enzyme 1 activant le modificateur de type ubiquitine (en) codée par le gène UBA1 est mutée chez les patients)[5].
Inhibition du système ubiquitine-protéasome
[modifier | modifier le code]Le Bortézomib est l'une des premières molécules développées dans ce but. Il a été utilisé expérimentalement dans le traitement du myélome[6].
Utilisation du système ubiquitine-protéasome en biologie cellulaire
[modifier | modifier le code]Une nouvelle technologie, appelée PROTAC pour PRoteolysis-TArgeting Chimeras, permet de détourner et d'utiliser ce système ubiquitine protéasome en biologie cellulaire dans un intérêt d'exploration du vivant, voire en thérapeutique[7]. Cette technologie consiste en l'utilisation d'une petite molécule chimique bi-fonctionnelle de synthèse qui va recruter simultanément une ubiquitine ligase et une protéine cible permettant leur recrutement puis le rapprochement spatial et l’induction d’une interaction protéine-protéine (PPI) non physiologique forçant l’ubiquitination de celle-ci et donc sa dégradation spécifique par le système ubiquitine protéasome[8].
Notes et références
[modifier | modifier le code]- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- « La voie de dégradation ubiquitine dépendante », sur planet-vie.ens.fr, ENS et UPMC
- (en) O. Staub, I. Gautschi, T. Ishikawa, K. Breitschopf, A. Ciechanover, L. Schild et D. Rotin, « Regulation of stability and function of the epithelial Na+ channel (ENaC) by ubiquitination », EMBO Journal vol. 16, pp. 6325–6336, 1997.
- (en) K. Tanaka, T. Suzuki, N. Hattori, et Y. Mizuno, « Ubiquitin, proteasome and parkin », Biochim Biophys Acta, vol. 1695, pp. 235-247, 2004.
- David B. Beck, Achim Werner, Daniel L. Kastner et Ivona Aksentijevich, « Disorders of ubiquitylation: unchained inflammation », Nature Reviews Rheumatology, vol. 18, no 8, , p. 435–447 (ISSN 1759-4790 et 1759-4804, DOI 10.1038/s41584-022-00778-4, lire en ligne, consulté le )
- (en) Paul G. Richardson et al., « A Phase 2 study of bortezomib in relapsed, refractory myeloma », New Eng J Med, vol. 348, pp. 2609-2617, 2003.
- (en) Asher Mullard, « First targeted protein degrader hits the clinic », Nature Reviews Drug Discovery, vol. 18, no 4, , p. 237–239 (DOI 10.1038/d41573-019-00043-6, lire en ligne, consulté le )
- Ian Churcher, « Protac-Induced Protein Degradation in Drug Discovery: Breaking the Rules or Just Making New Ones? », Journal of Medicinal Chemistry, vol. 61, no 2, , p. 444–452 (ISSN 0022-2623, DOI 10.1021/acs.jmedchem.7b01272, lire en ligne, consulté le )
- (en) Eyal Reinstein et Aaron Ciechanover, « Protein degradation and human diseases: The ubiquitin connection », Ann. Intern. Med., vol. 145, pp. 676-684, 2006.
