Valoración potenciométrica

En química analítica, la valoración potenciométrica es una técnica de determinación del punto final de una valoración o titulación en la que, en lugar de utilizar indicadores químicos visuales, se utiliza un electrodo. En el electrodo se produce algún tipo de reacción redox o de transferencia de carga que genera un potencial de electrodo o de semicelda cuya magnitud está relacionada con la concentración de alguna de las especies involucradas en la valoración, de forma que mediante medidas de potencial puede seguirse la valoración y determinar el punto final de esta.
Las valoraciones potenciométricas se utilizan con relativa frecuencia en valoraciones ácido-base, valoraciones redox y en algunas argentometrías, principalmente en las determinaciones de haluros con nitrato de plata. También se ha descrito el empleo de las valoraciones potenciométricas en algunas valoraciones complexométricas con EDTA.[1]
Historia
[editar]La primera titulación potenciométrica fue realizada en 1893 por Robert Behrend en el Instituto Ostwald de Leipzig. Valoró una solución mercuriosa con cloruro de potasio, bromuro de potasio y yoduro de potasio utilizando un electrodo de mercurio junto con un electrodo de referencia de mercurio/ nitrato mercurioso. Descubrió que en una celda compuesta de nitrato mercurioso y nitrato mercurioso/mercurio, el voltaje inicial es 0. Esta diferencia de potencial aumentaba lentamente a medida que se iba agregando cloruro de potasio adiciona. Descubrió que la mayor diferencia de potencial se lograba una vez que todo el nitrato mercurioso había precipitado. Esto se utilizó para localizar los puntos finales de las valoraciones. [2]
Después de estas primeras observaciones, Wilhelm Böttger utilizó la titulación potenciométrica para observar las diferencias en la valoración entre ácidos fuertes y débiles, así como el comportamiento de los ácidos polibásicos. [3] Introdujo la idea de utilizar titulaciones potenciométricas para ácidos y bases que no podían titularse junto con un indicador colorimétrico. [2]
Tras estos primeros pasos, las valoraciones potenciométricas comenzaron a utilizarse en valoraciones redox, siendo una de las primeras la determinación de haluro con permanganato potásico utilizando un electrodo de platino, como electrodo indicador y un electrodo de calomelanos, como electrodo de referencia. [2] Con el tiempo, el empleo de la valoración potenciométrica como herramienta del análisis químico se ha ido extendiendo y hoy día es frecuente su utilización rutinaria en análisis de suelos, en análisis industriales e incluso en biomedicina, etc. [4]ya que la valoración potenciométrica es especialmente útil en aquellos casos en que las disoluciones son turbias o coloreadas, lo que dificulta mucho la detección del punto final mediante el empleo de indicadores químicos visuales. [5]
Medida potenciométrica y toma de datos
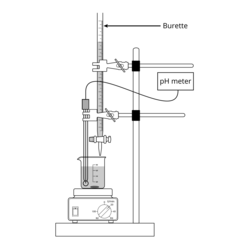
[editar]La valoración potenciométrica está basada en el monitoreo o seguimiento de los cambios de potencial que se producen durante la valoración, antes y después del punto de equivalencia. Para ello se requiere el empleo de un voltímetro o potenciómetro de laboratorio conectado a un electrodo indicador apropiado para el caso, por ejemplo un electrodo de vidrio sensible a pH si se va a valorar un ácido o una base o un electrodo de plata en el caso de las valoraciones de cloruro u otros halogenuros, con nitrato de plata como reactivo patrón.[6] Además, se requiere del empleo de un electrodo de referencia para poder establecer la diferencia de potencial entre ambos. El electrodo indicador forma una semicelda electroquímica con los iones de interés en la solución objeto del análisis. El electrodo de referencia forma la otra semicelda.
El potencial eléctrico total se calcula como
donde Esol incluye la caída de potencial del circuito y el potencial de unión líquida entre los electrodos y la disolución. El valor que toma Ecell se registra a medida que se agrega el reactivo valorante y con ello se obtiene un gráfico del potencial en función del volumen agregado y a partir de este, se deduce el punto final de la valoración. Puesto que el potencial de celda, Ecell está relacionado con el logaritmo de la concentración de los iones implicados, la curva de valoración toma un aspecto sigmoidal con un cambio brusco de tendencia en las inmediaciones del punto de equivalencia. Normalmente, el punto de inflexión de esta curva sigmoidal se considera que es el punto final de la valoración. Puesto que no siempre es fácil localizar este punto, habitualmente se recurre al tratamiento matemático de la curva, derivándola una o dos veces, para localizar el punto de inflexión de la curva, que corresponde con el punto final de la valoración.

La toma de los datos necesarios para el registro de la curva de valoración se puede hacer de forma manual, mediante el empleo de una bureta de valoración para añadir el reactivo valorante. En este caso, el operador añade porciones de reactivo valorante y trascurridos unos pocos segundos, mide y anota el potencial de celda (en voltios o en pH, según sea el caso) en función del volumen total de reactivo que lleva añadido. Una vez que se está seguro de que se ha sobrepasado el punto de equivalencia, tras la adición de algunas porciones más de valorante, se da por finalizada la valoración y los datos obtenidos se representan en una gráfica en la que las ordenadas son las medidas de potencial y las abscisas el volumen de valorante correspondiente a cada medida, con lo que se obtiene la típica curva de valoración potenciométrica.
La curva de valoración también se puede obtener de forma rápida mediante el empleo de los denominados valoradores automáticos, que son dispositivos equipados con un depósito que contiene la disolución de valorante y un sistema de suministro de este, como puede ser una bomba rotatoria o de jeringa, con sus correspondientes tubos y válvulas. La bomba se programa para que suministre el reactivo a una velocidad adecuada y el dispositivo registra simultáneamente la señal del potenciómetro que lleva acoplado. El registro se puede hacer directamente sobre papel gráfico, o más modernamente, se monitorea en la pantalla de un ordenador conectado al sistema de medida y una vez acabada la valoración se almacena en un archivo para su posterior tratamiento matemático.[5]
Cálculo del punto final
[editar]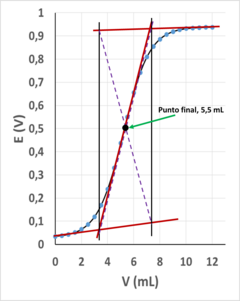
Una vez que se ha obtenido el gráfico con la curva de valoración, es necesario establecer el volumen en el cual se ha completado la reacción, es decir, el volumen correspondiente al punto final que permitirá realizar los correspondientes cálculos estequiométricos necesarios para establecer la concentración del analito. Este punto final se encuentra en el punto de inflexión de la curva de valoración y para establecerlo se pueden utilizar diferentes métodos. Uno de los procedimientos más rápidos y sencillos, aunque no el más preciso y exacto, es el denominado método de las tangentes, consistente en trazar tres líneas tangentes, una a cada tramo casi recto del comienzo y del final de la valoración y otra al tramo casi recto donde se produce el salto brusco de la señal medida por el pH-metro o por el potenciómetro de laboratorio. Las tres líneas se prolongan para encontrar los puntos de corte y desde ellos se trazan dos líneas paralelas al eje de ordenadas, obteniéndose una figura en forma de romboide. El cruce de las líneas que unen los vértices opuestos de este romboide corresponde con el punto final de la valoración. [7]El método de las tangentes ha sido de gran utilidad y ampliamente utilizado en las valoraciones potenciométricas automáticas, ya que los primeros valoradores solo proveían de registro gráfico de la curva de valoración, no almacenando los datos numéricos para su posterior tratamiento matemático.
Para aquellas curvas de valoración en la que las dos ramas de la sigmoide son relativamente simétricas, como ocurre en las valoraciones de ácido fuerte con base fuerte o viceversa, G. Gran propuso, en 1950, un método de trasformación y descomposición de la función sigmoide en líneas rectas a partir de las cuales se puede deducir el volumen fina de la valoración.[8]
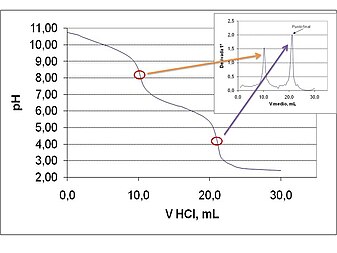
Sin embargo, el procedimiento más ampliamente utilizado es el de la detección del punto final mediante la derivada de la sigmoide, ya que la derivada primera de la función corresponde con la pendiente de la curva en cada uno de sus puntos. Como el punto final se produce en el punto de inflexión de la curva, este punto será el de mayor pendiente, es decir, presentará el mayor valor (positivo o negativo) de la derivada. La derivada se puede calcular utilizando los datos numéricos de la valoración de forma manual o semimanual con ayuda de un programa de hoja de cálculo. En estos casos, el procedimiento consiste en tabular cada uno de los incrementos de señal del milivoltímetro o del pH-metro que se produce entre dos adiciones consecutivas de reactivo (ΔE o ΔpH) y dividirlo por el incremento de volumen de reactivo valorante añadido (ΔE/ΔV ) y representarlo gráficamente frente al volumen promedio correspondiente ((V2-V1)/2).[9]Por razones de comodidad y economía de tiempo, es frecuente que la derivada se haga para los puntos próximos a los saltos que se producen en las proximidades de los puntos de equivalencia y que el valor de la derivada sea en valores absolutos, independientemente de que la curva de valoración sea creciente o decreciente. Alternativamente a estos cálculos manuales o semimanuales, que resultan algo tediosos, se pueden utilizar programas de tratamiento de datos científicos o de cálculo matemático (p. ej. MATLAB®) que, una vez leído el archivo con los datos de la valoración, lo representan y ejecutan la derivada, siguiendo las instrucciones suministradas por el operador.
En algunos casos, sobre todo cuando la pendiente es muy pequeña, es difícil localizar exactamente el punto final a partir de la curva derivada. Ante esta situación, es necesario utilizar la segunda derivada, es decir, derivar la curva de la primera derivada. En esta caso, no se pueden utilizar valores absolutos de datos de derivada, pues el punto final, ahora, corresponde con el volumen de reactivo valorante en el que la segunda derivada toma el valor cero o se cruza con el eje de abscisas.
Véase también
[editar]Referencias
[editar]- ↑ Schwedt, Georg (1997). «Cap. 5.3. Potentiometry-Application». The essential guide to analytical chemistry. Wiley. ISBN 978-0-471-97412-3. Consultado el 22 de agosto de 2024.
- ↑ a b c Szabadváry, Ferenc. History of Analytical Chemistry: International Series of Monographs in Analytical Chemistry. Elsevier, 2013.
- ↑ Burns, D. Thorburn, et al. Important Figures of Analytical Chemistry from Germany in Brief Biographies: From the Middle Ages to the Twentieth Century. Springer, 2014.
- ↑ Rouessac, Francis; Rouessac, Annick; Rouessac, Francis; Rouessac, Francis (2000). Chemical analysis: modern instrumental methods and techniques (Engl. ed edición). Wiley. pp. 355-356. ISBN 978-0-471-97261-7.
- ↑ a b Skoog, D. A.; Holler, F. J.; . Crouch, S. R. (2008). «Cap. 23I. Titulaciones potenciométricas». Principios de análisis instrumental. Mexico: Cengage Learning. ISBN 607-481-390-6.
- ↑ Higson, Séamus (2003). Analytical chemistry. Oxford university press. pp. 84-85. ISBN 978-0-19-850289-0. Consultado el 1 de septiembre de 2024.
- ↑ Muñoz Portero, María José. «Método de las tangentes para la determinación del punto final en valoraciones potenciométricas». Universidad Politécnica de Valencia.
- ↑ Gran, Gunnar; Dahlenborg, Hans; Laurell, S.; Rottenberg, Max (1950). «Determination of the Equivalent Point in Potentiometric Titrations.». Acta Chemica Scandinavica (en inglés) 4: 559-577. ISSN 0904-213X. doi:10.3891/acta.chem.scand.04-0559. Consultado el 2 de septiembre de 2024.
- ↑ Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch. (2015). «Cap. 21G. Valoraciones potenciométricas». Fundamentos de química analítica. Cengage Learning. ISBN 978-607-519-937-6.

