Wolfraam(VI)chloride
| Wolfraam(VI)chloride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
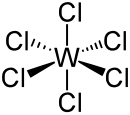
| ||||
Structuurformule van wolfraam(VI)chloride
| ||||
| Algemeen | ||||
| Molecuulformule | Cl6W | |||
| IUPAC-naam | wolfraam(VI)chloride | |||
| Andere namen | wolfraamhexachloride | |||
| Molmassa | 396,558 g/mol | |||
| SMILES | Cl[W](Cl)(Cl)(Cl)(Cl)Cl
| |||
| InChI | 1/6ClH.W/h6*1H;/q;;;;;;+6/p-6/f6Cl.W/h6*1h;/q6*-1;m/rCl6W/c1-7(2,3,4,5)6
| |||
| CAS-nummer | 13283-01-7 | |||
| EG-nummer | 236-293-9 | |||
| PubChem | 83301 | |||
| Wikidata | Q421188 | |||
| Vergelijkbaar met | Wolfraam(VI)fluoride | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| Hygroscopisch? | ja | |||
| Omgang | Niet inademen, contact en blootstelling vermijden. | |||
| VN-nummer | 3260 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vaste stof | |||
| Kleur | donkerblauw | |||
| Dichtheid | 3,52[1] g/cm³ | |||
| Smeltpunt | 275[1] °C | |||
| Kookpunt | 346[1] °C | |||
| Goed oplosbaar in | chloorkoolwaterstoffen | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | (α-vorm) trigonaal (β-vorm) hexagonaal | |||
| Dipoolmoment | 0 D | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Wolfraam(VI)chloride is een anorganische verbinding met als brutoformule WCl6. De stof komt voor als een donkervioletblauwe vluchtige vaste stof. Het is een belangrijke uitgangsstof bij de bereiding van andere wolfraamverbindingen.[2] Wolfraam(VI)chloride is een van de weinige neutrale hexachloriden; een andere is renium(VI)chloride (ReCl6). Molybdeen(VI)chloride (MoCl6) bestaat niet. Beter bekend dan wolfraam(VI)chloride is het nog vluchtigere wolfraam(VI)fluoride (WF6).
Structuur en eigenschappen
[bewerken | brontekst bewerken]Het centrale atoom in de octaëdrische molecule heeft een d0-configuratie en is derhalve net als afgeleide vormen met wolfraam(VI) diamagnetisch. De W-Cl-bindinglengten zijn gelijk: 224 tot 226 pm.[3]
Kristalstructuur
[bewerken | brontekst bewerken]Wolfraam(VI)chloride kent twee kristalstructuren. De alfastructuur is stabiel onder 226°C en heeft een trigonale structuur. Boven deze temperatuur wordt de structuur hexagonaal; dit is de bètavorm. In beide structuren zijn discrete WCl6-octaëders te herkennen en de chlooratomen vormen vrijwel dezelfde dichtste stapeling. De wolfraamatomen bevinden zich echter in andere octaëdrische holten binnen deze dichtste stapeling.[3]
Reacties
[bewerken | brontekst bewerken]Methylering met trimethylaluminium vormt hexamethylwolfraam. Met n-butyllithium ontstaat een reagens dat gebruikt kan worden voor de deoxygenatie van epoxiden.[4]
De chlorideliganden in wolfraam(VI)chloride kunnen vervangen worden door een groot aantal andere anionische liganden zoals Br−, NCS− en RO− (R = alkyl of aryl).
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Wolfraam(VI)chloride is een agressieve en corrosieve oxidator die onder invloed van vocht omgezet wordt in zoutzuur.
Externe links
[bewerken | brontekst bewerken]- ↑ a b c (en) Gegevens van wolfraam(VI)chloride in de GESTIS-stoffendatabank van het IFA (geraadpleegd op 23 december 2008)
- ↑ (en) J.W. Herndon (2004) - Tungsten(VI) Chloride, Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette), J. Wiley & Sons, New York
- ↑ a b (en) J.C. Taylor & P.W. Wilson (1974) - The structure of [beta]-tungsten hexachloride by powder neutron and X-ray diffraction, Acta Crystallographic, B30, pp. 1216-1220
- ↑ (en) M.A. Umbreit & K.B. Sharpless (1990) - Deoxygenation of Epoxides with Lower Valent Tungsten Halides: trans-Cyclododecene, Org. Synth.; Coll. Vol. 7, p. 121

