Zinkarsenid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Zn2+ _ As3− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Zinkarsenid | |||||||||||||||
| Andere Namen |
Trizinkdiarsenid | |||||||||||||||
| Verhältnisformel | Zn3As2 | |||||||||||||||
| Kurzbeschreibung |
grauer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 346,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
5,53 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Zinkarsenid ist eine anorganische chemische Verbindung des Zinks aus der Gruppe der Arsenide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Zinkarsenid kann durch Reaktion von Zink mit Arsen unter Stickstoff bei 700 °C gewonnen werden.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Zinkarsenid ist ein grauer Feststoff mit metallischer Leitfähigkeit. Durch Säuren erfolgt Zersetzung unter Arsenwasserstoff-Entwicklung.[1]
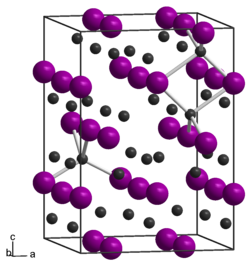
Die Verbindung besitzt eine tetragonal innenzentrierte Kristallstruktur (a = 1178 pm, c = 2364 pm) mit der Raumgruppe I41cd (Raumgruppen-Nr. 110). Sie enthält drei kristallographisch verschiedene Zinkatome, die aber alle tetraedrisch von Arsenatomen koordiniert sind. Bei erhöhter Temperatur erfolgt Umwandlung in andere Strukturen.[1] Die Verbindung ist ein II-V-Halbleiter.[4]
Das bei sonst gleichen Bedingungen bei Arsen-Überschuss entstehende schwarzgraue Zinkdiarsenid ZnAs2 schmilzt bei 768 °C und besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Nr. 14).[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Zinkarsenid wird zur Dotierung und zur Herstellung von Arsenwasserstoff in der Halbleiterindustrie verwendet.[5][6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 1033.
- ↑ a b c d e Datenblatt Zinc arsenide, pieces, 99.995% trace metals basis bei Sigma-Aldrich, abgerufen am 20. April 2014 (PDF).
- ↑ espimetals: Zinc Arsenide Zn3As2 - Zinc Arsenide Zn3As2, abgerufen am Sonntag, 20. April 2014
- ↑ Edward D. Palik: Handbook of Optical Constants of Solids. Academic Press, 1998, ISBN 0-12-544423-0, S. 595 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jeanne Mager Stellman: Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Organization, 1998, ISBN 92-2109816-8, S. 83.24 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Anthony C. Jones, Michael L. Hitchman: Chemical Vapour Deposition: Precursors, Processes and Applications. Royal Society of Chemistry, 2009, ISBN 0-85404-465-5, S. 546 (eingeschränkte Vorschau in der Google-Buchsuche).



