Acido xenico
| Acido xenico | |
|---|---|
 | |
| Nome IUPAC | |
| acido tetraosso xenico (VI) | |
| Caratteristiche generali | |
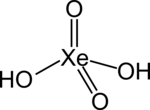
| Formula bruta o molecolare | H2XeO4 |
| Peso formula (u) | 197,31 |
| Numero CAS | |
| PubChem | 23422578 |
| SMILES | O[Xe](=O)(=O)O |
| Indicazioni di sicurezza | |
| Frasi R | -- |
| Frasi S | -- |
L'acido xenico è l'ipotetico acido inorganico di formula H2XeO4, acido diprotico dello xeno che non è mai stato isolato o evidenziato. Con il nome acido xenico si indica anche una soluzione di XeO3 in acqua, soluzione che formalmente porta alla formazione di H2XeO4. Queste soluzioni non conducono elettricità, mostrando che lo XeO3 presente non è dissociato.[1][2]
Le soluzioni di acido xenico sono fortemente ossidanti, dato che contengono XeO3:[3]
- XeO3 + 6H+ + 6e– ⇄ Xe + 3H2O E° = 2,10 V
Xenati
Anche se l'acido diprotico H2XeO4 non è mai stato evidenziato, esistono i suoi sali detti xenati, contenenti l'anione HXeO4– dove lo xeno ha numero di ossidazione +6. Gli xenati si ottengono per reazione di XeO3 con alcali in soluzione acquosa (M = K, Rb, Cs):[2]
- XeO3 + MOH → M[HXeO4]
Gli xenati disproporzionano lentamente formando xeno gassoso e perxenati XeO64–, dove lo xeno ha numero di ossidazione +8:[4]
- 2HXeO4– + 2OH– → XeO64– + Xe + O2 + 2H2O
Non si conoscono sali dell'anione completamente deprotonato XeO42–.[4]
Note
Bibliografia
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) A. F. Holleman e E. Wiberg, Inorganic chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- J. G. Malm, H. Selig, J. Jortner e S. A. Rice, The chemistry of xenon, in Chem. Rev., vol. 65, n. 2, 1965, pp. 199-236, DOI:10.1021/cr60234a003. URL consultato il 22 giugno 2010.
