Теллуроводород
| Теллуроводород | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
теллурид водорода | ||
| Традиционные названия | гидрид теллура, теллуран, дигидрид теллура, дигидротеллурид | ||
| Хим. формула | |||
| Физические свойства | |||
| Состояние | газ | ||
| Молярная масса | 129,6159 г/моль | ||
| Плотность | 3,310 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −49 °C | ||
| • кипения | −2,2 °C | ||
| Энтальпия | |||
| • образования | 99,60 кДж/моль | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 2,6 | ||
| Растворимость | |||
| • в воде | 0,7 г/100 мл | ||
| • в этаноле | растворим | ||
| Классификация | |||
| Рег. номер CAS | 7783-09-7 | ||
| PubChem | 21765 | ||
| Рег. номер EINECS | 231-981-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 49907 | ||
| ChemSpider | 20455 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Теллуроводоро́д (теллура́н) — бинарное неорганическое соединение водорода и теллура с формулой .
Представляет собой при нормальных условиях бесцветный, горючий, легкоразлагающийся газ с весьма неприятным запахом (напоминает чесночный запах арсина). Очень ядовит.
Структура
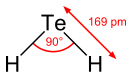
[править | править код]Молекула подобна молекуле сероводорода, имеет «изогнутую» структуру с углом между атомами водорода 89,5° и с расстоянием между атомами H и Te 0,169 нм. Дипольный момент равен 0,081 Д.
Химические свойства
[править | править код]Химические свойства теллуроводорода схожи со свойствами сероводорода, но в водных растворах более диссоциирован.
, как и селеноводород является очень сильным восстановителем, например, обесцвечивает раствор иода:
- .
очень нестойкое соединение, уже при 0 °C в темноте медленно разлагается на элементы, при освещении скорость разложения нарастает (фотодиссоциация). Жидкий на свету разлагается очень быстро, именно от этого он на свету весьма быстро приобретает зеленовато-жёлтый цвет из-за растворения в нём элементарного теллура:
- (1).
Теллуроводород горит в воздухе или кислороде синим пламенем, с образованием диоксида теллура и воды:
- .
Окисляется кислородом воздуха, особенно во влажном воздухе, до элементарного теллура даже при 0 °C:
- (2).
Получение
[править | править код]Для получения практически непригодны реакции взаимодействия теллуридов с водой или кислотами, так как из-за разложения образующегося его выход очень мал. Пример реакции:
- .
Поэтому используется электролитический метод с применением теллурового катода, платинового анода и серной (или ортофосфорной) кислот в качестве электролита при плотности тока несколько А/дм2 Процесс ведут при температуре около или немного ниже 0 °C.
Очистка
[править | править код]Выходящий из электролизёра газ (смесь , водорода, азота и водяного пара) предварительно глубоко осушают, пропуская последовательно через 2 колонки, наполненные плавленым хлоридом кальция и пентоксидом фосфора, затем для отделения водорода и азота газ пускают в приёмник, охлаждаемый жидким азотом или твердой углекислотой, где кристаллизуется. Процесс ведут в темноте или при очень слабом освещении.
Хранение
[править | править код]В твердом состоянии, при температуре жидкого азота. При этом разлагается очень медленно.
Предосторожности
[править | править код]Ввиду чрезвычайно высокой токсичности все работы с применением ведут в вытяжных шкафах.
Теллуриды
[править | править код]Раствор в воде называют теллуроводородной кислотой. Её соли называют теллуридами. Как правило, эти соли — устойчивые соединения. Практически все теллуриды плохо растворимы в воде и окрашены в чёрный либо серый цвет. Исключение составляют теллуриды щелочных металлов и аммония, а также теллурид бериллия — бесцветные гигроскопические кристаллы, образующие кристаллогидраты. Растворы теллуридов в результате гидролиза имеют щелочную реакцию.
Пример реакции, не имеющей практического значения из-за трудности получения :
- .
Поэтому теллуриды получают, как правило, прямым синтезом из элементов:
- .
Так как — двухосновная кислота, можно было бы ожидать существование наряду со средними кислых солей, например как у селенидов, однако гидротеллуриды неизвестны.
Многие теллуриды металлов, особенно II группы таблицы Менделеева, обладают полезными термоэлектрическими, полупроводниковыми и фотополупроводниковыми свойствами.
Применение
[править | править код]применяется в электронной технологии для получения тончайших плёнок металлического теллура на различных подложках в процессах разложения или окисления: (1), (2). Также применяется для легирования из газовой фазы арсенида галлия, придавая ему электронный тип проводимости.
Физиологическое действие
[править | править код]
Теллуроводород очень токсичен, является гемолитическим ядом. Вдыхание теллуроводорода вызывает головную боль, тошноту и общую слабость, в дальнейшем присоединяются нарушения дыхания и кровообращения.
Относится к 1-му классу опасности по ГОСТ 12.1.007-76[1].
Примечания
[править | править код]- ↑ ГОСТ 12.1.007-76 Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности (с Изменениями N 1, 2). Дата обращения: 19 марта 2021. Архивировано 14 апреля 2021 года.
Литература
[править | править код]- Гринвуд Н., Эрншо А. «Химия элементов». — Т. 1. — М.: БИНОМ. Лаборатория знаний, 2008 стр. 56.
- Гринвуд Н., Эрншо А. «Химия элементов». — Т. 2. — М.: БИНОМ. Лаборатория знаний, 2008 стр. 117.
- Некрасов Б. В. «Основы общей химии». — Т. 1. — М.: Химия, 1973 стр. 352.
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1977 стр. 104.
- Gal, J.-F.; Maria, P.-C.; Decouzon, M., The Gas-Phase Acidity and Bond Dissociation Energies of Hydrogen Telluride, Int. J. Mass Spectrom. Ion Proc., 1989, 93, 87.
- Новый справочник химика и технолога. Основные свойства неорганических, органических и элементорганических соединений / Редкол.: Скворцов Н. К. и др.. — СПб.: АНО НПО «Мир и семья», 2002. — 1280 с.