კადმიუმი
| კადმიუმი |
| 48Cd |
| 112.41 |
| 4d10 5s2 |
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ზოგადი თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | თეთრი მბზინვარე რბილი ლითონი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(Cd) |
112.414±0.004 112.41±0.01 (დამრგვალებული) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კადმიუმი პერიოდულ სისტემაში | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 48 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჯგუფი | 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 5 პერიოდი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Kr] 4d10 5s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 18, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა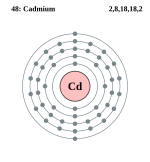 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა |
321.07 °C (594.22 K, 609.93 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა |
767 °C (1040 K, 1413 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 8.65 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 7.996 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 6.21 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 99.87 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 26.020 ჯ/(მოლი·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −2, +1, +2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 1.69 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 151 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 144±9 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 158 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
კადმიუმის სპექტრალური ზოლები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა |
მჭიდრო ჰექსაგონალური | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 2310 მ/წმ (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 30.8 µმ/(მ·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თბოგამტარობა | 96.6 ვტ/(მ·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კუთრი წინაღობა | 72.7 ნომ·მ (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | დიამაგნეტიკი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | −19.8×10−6 სმ3/მოლ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იუნგას მოდული | 50 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| წანაცვლების მოდული | 19 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დრეკადობის მოდული | 42 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0.30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოოსის მეთოდი | 2.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 203–220 მპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7440-43-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენი და პირველი მიმღებია | კარლ სამუელ ჰერმანი და ფრიდრიხ შტრომაიერი (1817) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სახელი დაარქვა | ფრიდრიხ შტრომაიერი (1817) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კადმიუმის მთავარი იზოტოპები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
კადმიუმი[1][2] (ლათ. Cadmium; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეხუთე პერიოდის, მეთორმეტე ჯგუფის (მოძველებული კლასიფიკაციით — მეორე ჯგუფის თანაური ქვეჯგუფის, IIბ) ქიმიური ელემენტი. მისი ატომური ნომერია 48, ატომური მასა — 112.41, tდნ — 321.07 °C, tდუღ — 767 °C, სიმკვრივე — 8.65 გ/სმ3. თეთრი მბზინვარე რბილი ლითონი. ბუნებრივი კადმიუმი შედგება ექვსი სტაბილური (, , , , და ) და ორი სუსტად რადიოაქტიული და იზოტოპისაგან. მშრალ ჰაერზე მდგრადია, ტენიან ჰაერზე მასზე ჩნდება კადმიუმის ოქსიდის თხელი ფენა, რომელიც ხელს უშლის მის შემდგომ ჟანგვას. 1817 წელს აღმოაჩინეს გერმანელმა ქიმიკოსებმა ფ. შტრომაიერმა და 1818 წელს მისგან დამოუკიდებლად კ. ჰერმანმა, კ კარსტენმა და ვ. მაისნერმა.
აღმოჩენის ისტორია
[რედაქტირება | წყაროს რედაქტირება]აღმოჩენილია გერმანელი პროფესორის ფრიდრიხ შტომეიერის მიერ 1817 წ. მაგდებურგის პროვიზორებმა თუთიის ოქსიდის ZnO შესწავლისას იეჭვიანეს მასში დარიშხანის მინარევის არსებობა. შტრომეიერმა გამოჰყო ZnO-საგან მუქი-ყავისფერი ოქსიდი, წყალბადით აღადგინა ის და მიიღო მოვერცხლისფრო-თეთრი ფერის ლითონი, რომელმაც მიიღო სახელწოდება - კადმიუმი.
სახელწოდების წარმომავლობა
[რედაქტირება | წყაროს რედაქტირება]შტრომაიერმა კადმიუმი დაარქვა მადნის ბერძნული სახელწოდების მიხედვით, საიდანაც გერმანიაში მოიპოვებდნენ თუთიას, — καδμεία. თავის მხრივ, მადანმა სახელწოდება მიიღო კადმის ძველბერძნული მითოლოგიის გმირის პატივსაცემად.
ბუნებაში
[რედაქტირება | წყაროს რედაქტირება]კადმიუმის საშუალო შემცველობა დედამიწის ქერქში შეადგენს 130 მგრ/ტ, ზღვის წყალში 0,11 მკგ/ლ. კადმიუმი მიეკუთვნება იშვიათ, გაბნეულ ელემენტებს: მას ბევრი მინერალი შეიცავს იზომორფული მინარევის სახით და ყოველთვის იმყოფება თუთიის მადნებში. ცნობილია მხოლოდ კადმიუმის 6 მინერალი. კადმიუმის ძალიან იშვიათ მინერალებს წარმოადგენენ გრინოკიტი CdS (77,8% Cd), ჰოულიიტიт, ოტავიტი CdCO3, მონტემპონიტი CdO (87,5% Cd), კადმოსელიტი CdSe (47% Cd), ქსანტოხროიტი CdS(H2O)х (77,2% Cd). კადმიუმის ძირითადი მასა გაბნეულია ბევრ მინერალებში (50-ზე მეტი), უპირატესად თუთიის, ტყვიის, სპილენძის, რკინის, მანგანუმის და ვერცხლისწყლის სულფიდებში. კადმიუმის მაქსიმალური კონცეტრაცია შეინიშნება თუთიის მინერალებში და, უპირველეს ყოვლისა, სფალერიტში (5%-მდე). უმეტეს შემთხვევაში კი კადმიუმის შემცველობა სფალერიტში არ აღემატება 0,4 – 0,6%. სხვა სულფიდებში, მაგალითად, სტანინში კადმიუმი არის მიახლოებით 0,003 – 0,2%, გალენიტში 0,005 – 0,02%, ჰალკოპირიტში 0,006 – 0,12%; ამ სულფიდებიდან კადმიუმს ჩვეულებრივ არ გამოყოფენ.
კადმიუმი არ წარმოქმნის დამოუკიდებელ საბადოებს, და შედის სხვა ლითონების საბადოების შემადგენლობაში. კადმიუმის შემცველობა შედარებით მაღალია საშუალოტემპერატურულ ტყვია-თუთიის საბადოებში და ნაწილობრივ სპილენძ-კოლჩედანის საბადოებში .
მიღება
[რედაქტირება | წყაროს რედაქტირება]ერთადერთი მინერალი, რომელიც საინტერესოა კადმიუმის მისაღებად არის - გრინოკიტი, ეგრეთ წოდებული "კადმიუმის მატყუარა». მას მოიპოვებენ სფალერიტთან ერთად თუთიის მადნების გადამუშავებისას. გადამუშავებისას კადმიუმი გროვდება პროცესის თანაურ პროდუქტებში, საიდანაც შემდეგ მას გამოჰყოფენ. ახლა წელიწადში ხდება 10³ ტონაზე მეტი კადმიუმის წარმოება.
ფიზიკური თვისებები
[რედაქტირება | წყაროს რედაქტირება]კადმიუმი — მოვერცხლისფრო-თეთრი რბილი ლითონია რომელსაც ჰექსაგონალური კრისტალური მესერი აქვს. თუკი კადმიუმის ჯოხს მოვღუნავთ, მაშინ გავიგებთ გაბზარვის ხმას - ეს ლითონის მიკროკრისტალები ეხახუნებიან ერთმანეთს (ასევე ხმაურობს კალას ჯოხიც).
ქიმიური თვისებები
[რედაქტირება | წყაროს რედაქტირება]კადმიუმი პერიოდულ სისტემაში იმავე ჯგუფშია სადაც, თუთია და ვერცხლისწყალი, და უჭირავს შუალედური ადგილი მათ შორის, ამიტომაც ამ ელემენტების ზოგი ქიმიური თვისებები მსგავსია. ამ ელემენტების სულფიდები და ოქსიდები წყალში პრაქტიკულად უხსნადია. კადმიუმი ნახშირბადთან არ ურთიერთქმედებს და არ წარმოქმნის კარბიდებს[3].
გამოყენება
[რედაქტირება | წყაროს რედაქტირება]შენადნობები
[რედაქტირება | წყაროს რედაქტირება]კადმიუმი გამოიყენება როგორც მაგარი სარჩილავების კომპონენტი (შენადნობები ვერცხლის, სპილენძის და თუთიის საფუძველზე) მათი დნობის ტემპერათურის დასაწევად. წარმოებული კადმიუმის მიახლოებით 10 % არის — საიუველირო შენადნობის და ადვილადლღვობადი შენადნობების კომპონენტი. კადმიუმისა და ოქროს შენადნობს აქვს მომწვანო ფერი[4][5].
დამცავი საფარები
[რედაქტირება | წყაროს რედაქტირება]წარმოებული კადმიუმის 40 % გამოიყენება ლითონებზე ანტიკოროზიული საფარის დასატანებლად.
დენის ქიმიური წყაროები
[რედაქტირება | წყაროს რედაქტირება]კადმიუმის მიახლოებით 20 % მიდის კადმიუმიანი ელექტროდების დასამზადებლად, რომლებიც გამოიყენება აკუმულატორებში (ნიკელ-კადმიუმის აკუმულატორი და ვერცხლი-კადმიუმის აკუმულატორი), ვესტონის ნორმალურ ელემენტებში, სარეზერვო ბატერეებში (ტყვია-კადმიუმის ელემენტი, ვერცხლისწყალი-კადმიუმის ელემენტი) და სხვა.
პიგმენტები
[რედაქტირება | წყაროს რედაქტირება]კადმიუმის მიახლოებით 20 % გამოიყენება არაორგანულ საღებავ ნივთიერებებში (სულფიდები და სელენიდები, არეული მარილები, მაგალითად, კადმიუმის სულფიდი — ლიმონის კადმიუმი).
მედიცინა
[რედაქტირება | წყაროს რედაქტირება]- ზოგჯერ კადმიუმი გამოიყენება ექსპერიმენტარულ მედიცინაში.
კადმიუმი გამოიყენება ჰომეოპატიურ მედიცინაში.
- ბოლო წლებში კადმიუმს გამოიყენებენ ახალი სიმსივნის საწინააღმდეგო ნანო-მედიკამენტების წარმოებაში სსრკ-ში 1950—ან წლებში ჩატარებული იქნა პირველი წარმატებული ექსპერიმენტები, რომელიც დაკავშირებული იყო სიმსივნის საწინააღმდეგო მედიკამენტების შემუშავებასთან, კადმიუმის ნაერთების საფუძველზე.
ღირებულება
[რედაქტირება | წყაროს რედაქტირება]კადმიუმზე ფასი 2011 წელს შეადგინა მიახლოებით 3$ - 1 კგ.
გამოყენების სხვა სფეროები
[რედაქტირება | წყაროს რედაქტირება]- კადმიუმის სულფიდი გამოიყენება აპკურ მზის ბატარეებში რომლის მარგი ქმედების კოეფიციენტია მიახლოებით 10—16 %, ასევე როგორც ძალიან კარგი თერმოელექტრული მასალა.
- კადმიუმი გამოიყენება როგორც ნახევარგამტარი მასალების და ლუმინოფორების კომპონენტი.
- კადმიუმი ძალიან კარგად იტაცებს სითბურ ნეიტრონებს და გამოიყენებენ ატომური რეაქტორების რეგულირებადი ღერძის დასამზადებლად ასევე როგორც ნეიტრონებისაგან დასაცავად. ზოგჯერ ეს თვისებები გამოიყენება სიმსივნის საწინააღმდეგო თერაპიის ექსპერიმენტალურ მოდელებში Neutron Capture Therapy
- კადმიუმის ფტორობორატი — მნიშვნელოვანი ფლუსია, გამოიყენება ალუმინისა და სხვა ლითონების რჩილვის დროს.
- კადმიუმის თბოგამტარობა აბსოლუტურ ნულთან ყველა ლითონს შორის ყველაზე მაღალია, ამიტომაც კადმიუმს ზოგჯერ გამოიყენებენ კრიოგენული ტექნიკისათვის.
ფიზიოლოგიური ქმედება
[რედაქტირება | წყაროს რედაქტირება]
კადმიუმის ნაერთები საწამლავია. განსაკუთრებულად საშიშია მისი ოქსიდის ორთქლის შესუნთქვა (CdO)[6]. ჰაერის შესუნთქვა 1 წთ-ის განმავლობაში რომელიც შეიცავს კადმიუმის ოქსიდს 2,5 გრ/მ3, ან 30 წმ-ის განმავლობაში სადაც კონცენტრაციაა 5 გრ/მ3 წარმოადგენს მომაკვდინებელს.[7] კადმიუმი წარმოადგენს კანცეროგენს[8].
პირველადი დახმარება მწვავე კადმიუმით მოწამვლისას არის სუფთა ჰაერი, სრული სიმშვიდე, გაცივების თავიდან აცილება. სასუნთქი გზების გაღიზიანებისას — თბილი რძე სოდით, ინჰალაცია 2 %-იანი NaHCO3-ის სხნარით. ძლიერი ხველებისას — კოდეინი, დიონინი, მდოგვის საფენები მკერდზე, საჭიროა ექიმის დახმარება. კადმიუმის მარილებით მოწამვლისას მის ანტიდოტს წარმოადგენს ალბუმინი ნატრიუმის კარბონატთან.[7]
მწვავე ტოქსიკურობა
[რედაქტირება | წყაროს რედაქტირება]კადმიუმის და ყველა მისი ნაერთის ორთქლი ტოქსიკურია, რაც დაკავშირებულია, კერძოდ, მის თვისებასთან დააკავშიროს გოგირდშემცველი ფერმენტები და ამინომჟავები.
კადმიუმის მარილებით მწვავე მოწამვლის სიმტომებია — ღებინება და კრუნჩხვები.
ქრონიკული ტოქსიკურობა
[რედაქტირება | წყაროს რედაქტირება]კადმიუმი — კუმულატიური საწამლავია (აქვს თვისება ორგანიზმში დაგროვებისა).
სანიტარულ-ეკოლოგიური ნორმატივები
[რედაქტირება | წყაროს რედაქტირება]სასმელ წყალში კადმიუმის ზღვრული დასაშვები კონცენტრაციაა 0,001 მგრ/დმ³ (СанПиН 2.1.4.1074-01).
ტოქსიკური ზემოქმედების მექანიზმი
[რედაქტირება | წყაროს რედაქტირება]კადმიუმის ტოქსიკური ზემოქმედების მექანიზმი ალბათ მდგომარეობს, კარბოქსილების, ამინების და განსაკუთრებულად ცილების მოლეკულების სულფჰიდრიდული ჯგუფების შეკავშირებასთან, რის შედეგად ქვეითდება ფერმენტული სისტემების აქტივობა[7]. კადმიუმის ხსნადი ნაერთები სისხლში მოხვედრის შემდეგ აავადდება ცენტრალური ნერვიული სისტემა, ღვიძლი და თირკმლები, ირღვევა ფოსფორ-კალციუმის მიმოცვლა. ქრონიკული მოწამლვა იწვევს ანემიას და ძვლების დაშლას.
კადმიუმი ნორმალური, მცირე რაოდენობით არის ჯანმრთელი ადამიანის ორგანიზმში. კადმიუმი ადვილად გროვდება მზარდ უჯრედებში (მაგალითად სიმსივნის ან სასქესო). ის უკავშირდება უჯრედების ციტოპლაზმატურ და ბირთვულ მასალას და აზიანებს მას. ის ცვლის ჰორმონებისა და ფერმენტების აქტიურობას. ეს განპირობებულია მისი თვისებით დააკავშიროს სულფჰიდრილური (-SH) ჯგუფები.
იზოტოპები
[რედაქტირება | წყაროს რედაქტირება]კადმიუმის არსებული რვა ბუნებრივი იზოტოპიდან ექვსი სტაბილურია, ორ იზოტოპზე აღმოჩენილია რადიოაქტიურობა. ესენია 113Cd (იზოთოპური გავრცობადობა 12,22 %, ბეტა-დაშლა ნახევარდაშლის პერიოდით 7,7×1015 წელი) და 116Cd (იზოთოპური გავრცობადობა 7,49 %, ორმაგი ბეტა-დაშლა ნახევარდაშლის პერიოდით 3,0×1019 წელი).
იხილეთ აგრეთვე
[რედაქტირება | წყაროს რედაქტირება]რესურსები ინტერნეტში
[რედაქტირება | წყაროს რედაქტირება]- კადმიუმი chemistry.ge-ზე
- კადმიუმი Webelements-ზე
- კადმიუმი ქიმიური ელემენტების პოპულარულ ბიბლიოთეკაში დაარქივებული 2016-12-05 საიტზე Wayback Machine.
სქოლიო
[რედაქტირება | წყაროს რედაქტირება]- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 98
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 5, თბ., 1980. — გვ. 296.
- ↑ კადმიუმის ქიმია. დაარქივებულია ორიგინალიდან — 2011-08-22. ციტირების თარიღი: 2010-05-16.
- ↑ ოქრო - რომელი ფერია მოდაში. დაარქივებულია ორიგინალიდან — 2010-11-20. ციტირების თარიღი: 2012-02-06.
- ↑ საიუველირო საქმე» ძვირფასი ლითონების შენადნობები. დაარქივებულია ორიგინალიდან — 2014-01-09. ციტირების თარიღი: 2012-02-06.
- ↑ კადმიუმი. დაარქივებულია ორიგინალიდან — 2011-08-22. ციტირების თარიღი: 2010-05-16.
- ↑ 7.0 7.1 7.2 კადმიუმისა და მისი ნაერთების ტოქსიკურობა :: შრომის დაცვა მეტალურგიაში
- ↑ McDonald‘s იბრუნებს 12 მლნ. ჭიქას კადმიუმის მინარევის გამო. ინტერფაქსი (4 ივნისი 2010). დაარქივებულია ორიგინალიდან — 2010-06-08. ციტირების თარიღი: 2010-06-04.
| ქიმიურ ელემენტთა პერიოდული სისტემა | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| 8 | 119 | 120 | ⁂ | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | ||||||||||
| ⁂ | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||










