კალა
| კალა |
| 50Sn |
| 118.71 |
| 4d10 5s2 5p2 |
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ზოგადი თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | თეთრი, მბზინვარე, რბილი, მძიმე და პლასტიკური ლითონი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(Sn) |
118.710±0.007 118.71±0.01 (დამრგვალებული) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კალა პერიოდულ სისტემაში | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჯგუფი | 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 5 პერიოდი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Kr] 4d10 5s2 5p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა |
231.93 °C (505.08 K, 449.47 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა |
2602 °C (2875 K, 4716 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 7.265 გ/სმ3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 6.99 გ/სმ3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 7.03 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 296.1 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 27.112 ჯ/(მოლი·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −4, −3, −2, −1, 0, +1, +2, +3, +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 1.96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 140 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 139±4 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 217 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
კალას სპექტრალური ზოლები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა |
ტეტრაგონალური მოცულობაცენტრირებული 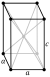 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა |
აჟურული 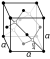 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 2730 m/s (ო. ტ.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 22.0 µმ/(მ·K) (25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თბოგამტარობა | 66.8 ვტ/(მ·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კუთრი წინაღობა | 115 ნომ·მ (0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | +3.1×10−6 სმ3/მოლ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იუნგას მოდული | 50 გპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| წანაცვლების მოდული | 18 გპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დრეკადობის მოდული | 58 გპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოოსის მეთოდი | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 50–440 მპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენია | protohistoric, around 35th century BC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კალას მთავარი იზოტოპები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
კალა[1][2] (ლათ. Stannum; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეხუთე პერიოდის, მეთოთხმეტე ჯგუფის (მოძველებული კლასიფიკაციით — მეოთხე ჯგუფის მთავარი ქვეჯგუფის, IVა) ქიმიური ელემენტი. მისი ატომური ნომერია 50, ატომური მასა — 118.71, tდნ — 231.93 °C, tდუღ — 2602 °C, სიმკვრივე — 7.265 გ/სმ3. თეთრი, მბზინვარე, რბილი, მძიმე და პლასტიკური ლითონი. ბუნებრივი კალა შედგება ათი იზოტოპისაგან , , , , , , , , და . კალა და მისი შენადნობი სპილენძთან — ბრინჯაო— ცნობილია უძველესი დროიდან. კალა ამჟღავნებს ქიმიურ მსგავსებას მისი ჯგუფის ორივე მოსაზღვრე ელემენტთან: გერმანიუმთან და ტყვიასთან, რაც გამოიხატება დაჟანგვის ორი შესაძლებლობით, +2 და +4 (ვალენტობა). კალა 49-ე ყველაზე გავრცელებული ელემენტია. კალა ძირითადად მოიპოვება მინერალ კასიტერიტიდან, რომელიც შეიცავს კალას, კალის დიოქსიდის (SnO2) სახით.
ნორმალურ პირობებში მარტივი ნივთიერება კალა — პლასტიკური, ჭედადი და ადვილად დნობადი ბრჭყვიალა, მბზინვარე მოვერცხლისფრო-თეთრი ფერის რბილი ლითონია[3]. კალა წარმოქმნის ორ ალოტროპულ მოდიფიკაციას: 13,2 °С ტემპერატურაზე დაბლა მდგრადი α-კალა (ნაცრისფერი კალა) ალმასის ტიპის კუბური კრისტალური მესერით, 13,2 °С ტემპერატურაზე მაღლა მდგრადი β-კალა (თეთრი კალა) ტეტრაგონალური კრისტალური მესრით.
კალა მიეკუთვნება მსუბუქ ლითონებს. ჰაერზე ადვილად არ იჟანგება, რის გამოც გამოიყენება სხვა ლითონების დასაფარად კოროზიისგან დასაცავად. ფართოდ გამოიყენება კალას შენადნობები, განსაკუთრებით ტყვიასთან. კალასა და ტყვიის შენადნობი ადვილად ლღვება დაბალ ტემპერატურაზე და გამოიყენება სადენების ერთმანეთზე მისარჩილავად. კოროზიასთან ბრძოლის კიდევ ერთი მაგალითია, ფოლადის მოკალვა. კალას დაბალი ტოქსიკურობის გამო, მოკალული ფოლადი გამოიყენება საკვების შესაფუთად, კონსერვის ქილების სახით (თუმცა კონსერვის ქილებს ამზადებენ ალუმინისაგანაც).
ისტორია
[რედაქტირება | წყაროს რედაქტირება]კალა ადამიანისათვის ცნობილი იყო ჯერ კიდევ ძვ. წ. IV ათასწლეულში ეს ლითონი ნაკლებად მისაწვდომი იყო და ამიტომაც ძვირადღირებული, ამ ლითონის ნაკეთობები იშვიათად გვხვდება ძველ რომსა და ძველ საბერძნეთში. კალა მოხსენიებულია ბიბლიაში, მოსეს მეოთხე წიგნში. კალა (სპილენძთან ერთად) წარმოადგენს ბრინჯაოს ერთ-ერთ კომპონენტს (იხ. სპილენძისა და ბრინჯაოს ისტორია), რომელიც გამოგონილ იქნა ძვ. წ. III ათასწლეულის შუა ან ბოლო პერიოდში. რადგანაც ბრინჯაო წარმოადგენდა ყველაზე მტკიცეს იმ დროისათვის ცნობილ ლითონებსა და შენადნობებს შორის, კალა იყო „სტარტეგიული ლითონი“ მთელი ბრინჯაოს ხანის განმავლობაში, 2000 წელზე მეტი დროის განმავლობაში (მიახლოებით: ძვ. წ. XXXV—XI ს.).
სახელწოდების წარმომავლობა
[რედაქტირება | წყაროს რედაქტირება]ლათინური სახელწოდება stannum, დაკავშირებულია სანსკრიტულ სიტყვასთან, რომელიც ნიშნავს „მდგრად, მტკიცეს“, თავიდან ის მიესადაგებოდა სიტყვა ტყვიას და ვერცხლს, ხოლო მოგვიანებით კი სხვა მის იმმიტირებელ შენადნობს, რომელიც შეიცავდა მიახლოებით 67 % კალას; IV საუკუნისათვის ამ სიტყვით დაიწყეს უკვე კალის აღნიშვნა.
სიტყვა олово — საერთო სლოვიანურში, რომელსაც გააჩნია შესაბამისობა ბალტიკურ ენებში (შედ. ლიტ. alavas, alvas — „олово“, პრუს. alwis — „ტყვია“). ის არის სუფიქსალური წარმონაქმნი ფუძიდან ol- (შედ. ძველზედაგერმანულ elo — „ყვითელი“, ლათ. albus — „თეთრი“ და სხვა), ასე რომ ლითონს დაარქვეს სახელი ფერიდან გამომდინარე[4].
არსებობა ბუნებაში
[რედაქტირება | წყაროს რედაქტირება]კალა — იშვიათი გაბნეული ელემენტია, დედამიწის ქერქში გავრცელების მიხედვით ის 47-ე ადგილზეა. კლარკის შემცველობა დედამიწის ქერქში შეადგენს, სხვადასხვა მონაცემებით მასის 2×10−4-დან 8×10−3 %-მდე. კალის ძირითადი მინერალია — კასიტერიტი (კალის ქვა) SnO2, რომელიც შეიცავს 78,8 %-მდე კალას. შედარებით იშვიათია სტანინი (კალის კოლჩედანი) — Cu2FeSnS4 (27,5 % Sn).
საბადოები
[რედაქტირება | წყაროს რედაქტირება]კალას მსოფლიო საბადოები მდებარეობენ სამხრეთ-აღმოსავლეთ აზიაში, ძირითადად ჩინეთში, ინდონეზიაში, მალაიზიაში და ტაილანდში. ასევე დიდი საბადოები განლაგებულია სამხრეთ ამერიკასა (ბოლივიაში, პერუში, ბრაზილიაში) და ავსტრალიაში.
გავრცელება ბუნებაში
[რედაქტირება | წყაროს რედაქტირება]კალას ბუნებაში გავრცელება ასახულია შემდეგ ცხრილში[5]:
| გეოლ. ობიექტი | ქვა. მეტეორიტი | დუნიტი და სხვა. | ბაზალტი და სხვა. | დიორიტი და სხვა. | გრანიტოიდები | თიხები და სხვა. | ოკეანის წყლები | ცოცხალი ნივთ. (% ცოცხალ წონაზე) | ნიადაგი | მცენარის ნაცარი |
|---|---|---|---|---|---|---|---|---|---|---|
| შემცველობა, წონა. % | 1×10−4 | 5×10−5 | 1,5×10−4 | − | 3×10−4 | 1×10−3 | 7×10−7 | 5×10−5 | 1×10−3 | 5×10−4 |
დაუბინძურებული წყლების ზედაპირზე კალას შემცველობა სუბმიკროგრამულ კონცენტრაციებშია. მიწისქვეშა წყლებში მისი კონცენტრაცია აღწევს მიკროგრამების ერთეულებს დმ³-ში, რომელიც მატულობს კალას საბადოების რაიონებში, ისინი წყლებში ხვდებიან უპირველეს ყოვლისა სულფიდური მინერალების დაშლის ხარჯზე, რომლებიც არამდგრადები არიან ჟანგვის ზონებში. Sn = 2 მგ/დმ³.

კალა წარმოადგენს ამფოტერულ ელემენტს, ანუ ელემენტს, რომელიც ავლენს როგორც მჟავა ასევე ფუძე თვისებებს. კალას ეს თვისება განსაზღვრავს მის გავრცელების თავისებურებებს ბუნებაში. ამ ორმაგი თვისებებიდან გამომდინარე კალა ავლენს ლიტოფილურ, ხალკოფილურ და სიდეროფილურ თვისებებს. კალა თავისი თვისებებით ავლენს სიახლოვეს კვარცთან, რის შედეგად ცნობილია მჭიდრო კავშირი კალას ჟანგს (კასიტერიტი) და მჟავე გრანიტოიდებს (ლიტოფილურობა) შორის. რაც ხშირად იწვევს კალათი გამდიდრებული, დამოუკიდებელ კვარც-კასიტერიტული ძარღვის წარმოქმნას. კალას ფუძე თვისობრივი მოქმედება განპიროვნებულია საკმაოდ მრავალფეროვანი სულფიდური წარმონაქმნებისაგან (ხალკოფილურობა), თვითნაბადი კალას და სხვადასხვაგვარი ინტერლითონური ნაერთების წარმოქმნამდის, რომლებიც ცნობილია ულტრაფუძიან ქანებში (სიდეროფილურობა).
არსებობის ფორმები
[რედაქტირება | წყაროს რედაქტირება]კალას ბუნებაში არსებობის ძირითადი ფორმები მინერალებში და ქანებში - არის გაბნეული (ან ენდოკრიპტონული). მაგრამ კალა ასევე ქმნის მინერალურ ფორმებს, და ამ სახით ხშირად გვხვდება არა მარტო როგორც აქცესორი მჟავე მაგმატიკურ ქანებში, არამედ ქმნის სამრეწველო კონცენტრაციას, უპირატესად დამჟანგავ გარემოში (კასიტერიტი SnO2) და სულფიდურ (სტანინი) ფორმებში[6].
მყარი ფაზა. მინერალები
[რედაქტირება | წყაროს რედაქტირება]
შესაძლებელია გამოვყოთ კალას არსებობის შემდეგი ფორმები ბუნებაში:
- გაფანტული ფორმა; კალას არსებობის კონკრეტული ფორმა ამ სახით არაა ცნობილი. აქ შეიძლება ითქვას კალას ბუნებაში იზომორფულ გაფანტულ ფორმაზე, რიგი ელემენტების იზომორფიზმის შედეგად (Ta, Nb, W — ტიპური ჟანგბადიანი ნაერთების წარმოქმნით; V, Cr, Ti, Mn, Sc — ჟანგბადიანი და სულფიდური ნაერთების წარმოქმნით). თუკი კალას კონცენტრაცია არ აღემატება ზოგ კრიტიკულ მნიშვნელობებს, მაშინ ის იზომორფულად შეუძლია შეცვალოს დასახელებული ელემენტები. იზომორფიზმის მექანიზმები სხვადასხვაგვარია.
- მინერალური ფორმა: კალა დადგენილია მინერალ-კონცენტრატორებში. როგორც წესი, ეს ის მინერალებია, რომლებშიც არსებობს რკინა Fe+2: ბიოტიტები, ძოწები, პიროქსენები, მაგნეტიტები, ტურმალინები და სხვა. ეს კავშირი დაფუძნებულია იზომორფიზმზე, მაგალითად სქემით Sn+4 + Fe+2 → 2Fe+3. კალამატარებელ ქანებში კალას მაღალი კონცენტრაცია დადგენილია ძოწებში (წონის 5,8 %-მდე) (განსაკუთრებით ანდრადიტებში), ეპიდოტებში (წონის 2,84 %-მდე) და სხვა.
სულფიდურ საბადოებში კალა შედის როგორც იზომორფული ელემენტი სფალერიტები (სილინსკის საბადო, რუსეთი, პრიმორიე), ქალკოპირიტები (დუბროვსკის საბადო, რუსეთი, პრიმორიე), პირიტები. კალას მაღალი კონცენტრაცია გამოვლენილია პიროტინებში. ითვლება რომ, შეზღუდული იზომორფიზმის გამო ხდება მყარი ნარევების დაშლა მიკროგამონაყოფებით Cu2+1Fe+2SnS4 ან ტილიტები PbSnS2 და სხვა მინერალები.
მინერალური ფორმები
[რედაქტირება | წყაროს რედაქტირება]თვითნაბადი ელემენტები, შენადნობები და ინტერლითონური ნაერთები
[რედაქტირება | წყაროს რედაქტირება]მიუხედავად იმისა რომ ქანებში ამ მინერალების კონცენტრაცია ძალიან დაბალია, მაინც გავრცელებულნი არიან გენეტიკური წარმონაქმნების ფართო წრეში. თვითნაბადი ფორმებს შორის კალასთან ერთად გამოვლენილია Fe, Al, Cu, Ti, Cd და სხვა, თუ არ ჩავთვლით ცნობილ პლატინოიდ ლითონებს, ოქროს და ვერცხლს. ეს ელემენტებივე ქმნიან სხვადასხვაგვარ შენადნობებს ერთმანეთთან: (Cu + Sn + Sb), (Pb + Sn + Sb) და სხვა, ასევე მყარი ხსნარები. ინტერლითონური ნაერთებს შორის დადგენილია სტისტაიტი SnSb, ატაკიტი (Pd,Pt)3Sn, შტუმირლიტი Pt(Sn,Bi), ზვიაგინცევიტი (Pd,Pt)3(Pb,Sn), ტაიმირიტი (Pd,Cu,Pt)3Sn და სხვა[7][8].
მოყვანილი კალას და სხვა ელემენტების არსებობის ფორმები გვხვდებიან სხვადასხვა გეოლოგიურ წარმონაქმნებში:
- ინთრუზიული და ეფუზიური მაგმატიკური ქანების ჯგუფი: ციმბირის პლატფორმის ტრაპები, პიკრიტები, კამჩატკის გიპერბაზიტები და გაბროიდები, იაკუტიის კიმბერლიტები, ალდანის ლამპროიტები და სხვა; პრიმორიის, ტიან-შანის, შორეული აღმოსავლეთის გრანითოიდები.
- მეტასომატიკურად და ჰიდროთერმულად შეცვლილი ქანების ჯგუფი: ციმბირის პლატოს სპილენძ-ნიკელიანი მადნები, ურალის, კავკასიის, უზბეკეთის ოქროს შემცველ მადნის ობიექტები[9].
- თანამედროვე მადანწარმოქმნის ჯგუფი: წყნარი ოკეანის პელაგიური დანალექები, უზონის ჰიდროთერმული სისტემა, კამჩატკაზე და სხვა.
- სხვადასხვა წარმოშობის დანალექი ქანების ჯგუფი.
კალას ჟანგური ნაერთები
[რედაქტირება | წყაროს რედაქტირება]ყველაზე ცნობილ ფორმას წარმოადგენს კალას მთავარი მინერალი — კასიტერიტი SnO2, რომელიც წარმოადგენს კალას ნაერთეს ჟანგბადთან. ბირთვული გამა-რეზონანსული სპექტროსკოპიის მონაცემებით იმყოფება Sn+4.
კასიტერიტი
[რედაქტირება | წყაროს რედაქტირება]კასიტერიტი (ბერძნ. kassiteros — კალა) — მთავარი მადნეული მინერალი კალას მისაღებად. თეორიულად შეიცავს კალას 78,62 % Sn. ქმნის მარცვლების ცალკე გამონაყოფებს, ერთიანი მასიურ აგრეგატებს, სადაც მინერალის მარცვლის ზომა აღწევს 3 — 4 მმ და ზოგჯერ მეტსაც.
- სიმკვრივე 6040-7120 კგ/მ³ (ყველაზე დაბალი ღიაშეფერილობის კასიტერიტებში).
- სიმაგრე 6½.
- ბზინვარება — მქრქალი, წიბიები — ალმასური.
- დაჩილვა არასრულყოფილი.
კასიტერიტის გამონაყოფის ძირითადი ფორმები:
- მიკროჩანართები სხვა მინერალებში;
- ქანებსა და მადნებში მინერალის აქცესორული გამონაყოფები;
- ერთიანი ან ჩანართული მადნები: ნემსური რადიალ-სხივური აგრეგატები, კოლომორფული და კრიპტოკრისტალული გამონაყოფი; კრისტალური ფორმა — კასიტერიტის გამოყოფის მთავარი ფორმა. კასიტერიტის საბადოები განლაგებულია: რუსეთში, მალაიზია, ტაილანდში, ინდონეზიაში, ჩსრ, ბოლივიაში, ნიგერიაში და სხვა.
ჰიდროჟანგული ნაერთები
[რედაქტირება | წყაროს რედაქტირება]მეორე ადგილზე მდებარეობს კალას ჰიდროჟანგულ ნაერთებს, რომლებიც შეიძლება განხილულ იქნას როგორც პოლიკალანური მჟავების მარილები. მათ მიეკუთვნება მინერალი სუკულაიტი Ta2Sn2+2O [10]; კალას მყარი ხსნარი მაგმატიკური სახით Fe2SnO4 ან Fe3SnO3 (ბრეტშტეინი ი. ს., 1974;ვორონინა ლ. ბ. 1979); „ვარლამოვიტი“ — სტანინის დაჟანგვის პროდუქტი; ითვლება რომ, ის წარმოადგენს კალას ამორფულ და ნახევრადამორფულ ნაერთების ნარევებს, მეტაკალას მჟავები, პოლიკონდენსირებული ფაზები და ჰიდროკასიტერიტული ფაზები. ცნობილია ასევე ჟანგვის ჰიდრატირებული პროდუქტები ჰიდრომარტიტი 3SnOxH2O; მუშისტონიტი (Cu,Zn,Fe)Sn(OH)6; სპილენძის ჰიდროსტანატი CuSn(OH)6 და სხვა.
სილიკატები
[რედაქტირება | წყაროს რედაქტირება]ცნობილია კალას სილიკატების მრავალმრიცხოვანი ჯგუფი, წარმოდგენილია მალაიაიტით CaSn[SiO5] [11]; პაბსტიტით Ba (Sn, Ti)Si3O9 [12], სტაკაზიტით Ca2Sn2Si6O18x4H2O და სხვა. მალაიაიტი წარმოქმნის სამრეწველო კონცენტრაციასაც.
შპინელიდები
[რედაქტირება | წყაროს რედაქტირება]სხვა ჟანგოვან ნაერთებიდან ცნობილი არის ასევე შპინელიდები, მაგალითად, მინერალი ნიგრეტიტი Sn2Fe4Al16О32 (Peterson E.U., 1986).
კალას სულფიდური ნაერთები
[რედაქტირება | წყაროს რედაქტირება]ჩართულია კალას და გოგირდის სხვადასხვაგვარი ნაერთები. ეს არის კალას არსებობის მინერალური ფორმის მეორე სამრეწველო მნიშვნელობის ჯგუფი. ყველაზე მნიშვნელოვანი მათ შორის არის სტანინი, მნიშვნელობით მეორე მინერალი. ამას გარდა აღსანიშნავია ფრანკეიტი Pb5Sn3Sb2S14, გერცენბერგიტი SnS, ბერნდტიტი SnS2, ტილიტი PbSnS2 და კესტერიტი Cu2ZnSnS4. გამოვლენილია უფრო რთული სულფიდური ნაერთები კალასა და ტყვიასთან, ვერცხლთან, სპილენძთან, რომელსაც აქვს უფრო მინერალოგიური მნიშვნელობა. მჭიდრო კავშირი კალასა და სპილენძთან განპიროვნებულია კალაშემცველ მადნებთან ხალკოპირიტის ხშირი არსებობა CuFeS2.
სტანინი
[რედაქტირება | წყაროს რედაქტირება]სტანინი (ლათ. stannum — კალა), კალას კოლჩედანი, სულფიდების კლასის მინერალი - საერთო ფორმულით Cu2FeSnS4. ის მიღებულია ქალკოპერიტის ფორმულიდან Fe ერთი ატომის შეცვლით Sn-ით. შეიცავს 29,58 % Cu, 12,99 % Fe, 27,5 % Sn და 29,8 S, ასევე მინარევებს Zn, Sb, Cd, Pb და Ag. ფართოდ გავრცელებული მინერალი კალაშემცველ საბადოებში. რუსეთის და შუა აზიის (ტაჯიკეთი) სამადოებთან ერთად ის წარმოადგენს სულფიდური მინერალების მნიშვნელოვან ელემენტს და ხშირად ის ვარლამოვიტთან ერთად შეადგენს მთელი კალას 10—40 %-ს. ხშირ შემთხვევაში შეინიშნება სტანინის დაშლა კასიტერიტის გამოყოფით.
კოლოიდური ფორმა
[რედაქტირება | წყაროს რედაქტირება]კოლოიდური და კალა-სილიციუმიანი ნაერთები თამაშობენ მნიშვნელოვან როლს კალას გეოქიმიაში, თუმცა დეტალურად ის შესწავლილი არ არის. ელემენტის გეოლოგიაში მნიშვნელოვან ადგილს თამაშობს კოლომორფული ნაერთები და კრისტალური გარდაქმნების პროდუქტები კრისტალურ სხვაობებში. კოლომორფული კასიტერიტი განიხილება როგორც გელისმაგვარი ბლანტი ხსნარების გამოხატვის ფორმები.
დამოუკიდებელმა კვლევარებმა გამოავლინეს ანომალურად მაღალი ხსნადობა SnO2 ქლორ-სილიციუმიან ხსნარებში. მაქსიმალური ხსნადობა მიიღწევა შეფარდებისას .
ნაერთის Sn(OH)4 თვისებების ანალიზით გამოვლენილია თვისება Si(OH)4 პოლიმერიზაციისადმი ბოლოს ნაერთის H2SnkO2k+1, SnkO2k−1(OH)2 წარმოქმნით. ორივე შემთხვევაში შესაძლებელია ჯგუფების (ОН) ჩანაცვლება ანიონებით F და Cl.
ასე რომ, Sn(OH)4 მოლეკულების პოლიმერიზაცია და მათი შეერთება Si(OH)4 მოლეკულენთან მიდის გელის (კოლოიდი) წარმოქმნამდე და ჯაჭვების წარმოქმნამდე HmSn2nSinOp, სადაც m ≤ 8 [13], ან Hs[SiO2n(SnOm)d] (ნეკრასოვი ი. ი. და სხვა, 1973).
არსებული მონაცემები აჩვენებენ, რომ კოლოიდური ფორმა არის ბუნებრივი შუალედური რგოლი ჰიდროთერმული ხსნარებიდან კალას გამოსაყოფად.
კალას არსებობა თხევად ფაზაში
[რედაქტირება | წყაროს რედაქტირება]კალას გეოქიმიის ყველაზე ნაკლებად შესწავლილი ნაცილია. კონკრეტულად კალაშემცველ ბუნებრივი ხსნარების ანალიზაე ნამუშევრები არ არსებობს. ძირითადად მთლიანად ინფორმაცია დაფუძნებულია ექსპერიმენტალურ კვლევების რეზულტატებზე, რომლებიც მხოლოდ ამბობენ კალას შეასძლებელ ფორმებზე ხსნარებში. მნიშვნელოვანი როლი შეასრულა ამაში აკადემიკოს ბარსუკოვის კვლევის მეთოდებმა[6]
ყველაფრის ერთობლიობა, კალას ექსპერიმენტალურად დადგენილი არსებობის ფორმები ხსნარებში იყოფა ჯგუფებად:
- იონური ნაერთები. ეს ნაერთები და მათი სტრუქტურა აღწერილია კლასიკური ვალენტური პოზიციიდან და სტერეიქიმიური წრამოდგენებით. იყოფა ქვეჯგუფებად:
- უბრალო იონები Sn+2 და Sn+4 ძირითადად აღმოჩენილია მაგმატიკურ შენადნობებში, ასევე ჰიდროთერმულ ხსნარებში, რომელასც გააჩნიათ დაბალი рН მნიშვნელობა. მაგრამ არსებულ ჰიდროთერმულ სისტემებში, ასახულს აირო-თხევადი ჩანართების შემადგენლობით, ასეთი პირობები არაა დადგენილი.
- ჰალოიდური მჟავების მარილები - SnF2, SnF40, SnCl40. ითვლება რომ, ქლორის როლი კალას და თანმყოლო ლითონების გადატანასა და გამოყოფაში უფრო მნიშვნელოვანია, ვიდრე ფთორის როლი.
- კალას ჰიდროქსილური ნაერთები. ტუტე პირობებში თავდაპირველი ნაერთებია H2SnO2, H2SnO4, H2SnO3. ეს ფორმები ხშირად დგება კარგად ცნობილი მინერალების საფუძველზე. ამ ფორმების ნაწილს გააჩნია როგორც ხელოვნური (CaSnO3, Ca2SnO4), ასევე ბუნებრივი (FeSnO2, Fe2SnO4) წარმოშობა. მჟავა გარემოში ეს ნაერთები იქცევიან როგორც სუსტი ფუძეები მაგალითად Sn(OH)2, Sn(OH)4. ითვლება რომ, ერთ-ერთი გამოვლენის ფორმა ასეთი ნაერთებისათვის არის ვარლამოვიტი. ექსპერიმენტებზე დაყრდნობით Sn(OH)4 ყოვნდება მხოლოდ Т< 280 °C სუსტმჟავა ხსნარებში ან ნეიტრალურ პირობებში рН = 7 — 9. ნაერთები Sn(OH)4 და Sn(OH)3+ მდგრადია рН= 7 — 9, ხოლო Sn(OH)2+2 და Sn(OH)+2 — მხოლოდ рН < 7.
ძალიან ხშირად ჯგუფები (ОН)−1 ჩაინაცვლება F და Cl, კალას ჰიდრონაერთების ჰალოგენოშეცვლადი მოდიფიკაციის შექმნით. საერთო სახით ეს ფორმები წარმოადგენილნი არიან ნაერთებით Sn(OH)4-kFk ან Sn(OH)4-kFk-nn. ერთად კი ნაერთები Sn(OH)3F მდგრადებია არიან Т = 25 — 50 °C, ხოლო Sn(OH)2F² Т = 200 °C-ის დროს. - სულფიდური ნაერთები. ექსპერიმენტების რეზულტატებით ხსნარებში არსებობენ ნაერთები SnS4−4 ან SnS3−2 ტიპის рН > 9; SnS2O−2 (pH = 8 — 9) და Sn(SH)4 (pH = 6). არის ნახსენები ნაერთი Na2SnS3 -ის ტიპის, არამდგრადი მჟავა გარემოში.
- კომპლექსური ნაერთები კალა შესწავლილია კასიტერიტების გახსნისას ფტორირებულ გარემოში. ეს ნაერთები გამოირჩევიან მაღალი ხსნადობით. ამავე თვისებებით ხასიათდებიან ნაერთები, რომლებიც მიღებულნი არიან ქლორიდულ ხსნარებში. კომპლექსური ნაერთების ძირითად ფორმებიდან, ექსპერიმენტებიდანაა ცნობილი, შეიძლება დასახელდეს Na2[Sn(OH)6], Na2[SnF6], Na2[Sn(OH)2F4] და სხვა. ექსპერიმენტებმა აჩვენა, რომ კომპლექსი Sn(OH)4F2−2 Т = 200 °C-ის დროს.
- კოლოიდური და კალა-სილიციუმიანი ნაერთები. მათ არსებობაზე ამბობს ბევრ სამადოებზე კასიტერიტის კოლომორფული გამოყოფების არსებობა. იხილეთ ზემოთ.
კალას საბადოების სამრეწველო ტიპები
[რედაქტირება | წყაროს რედაქტირება]კალას გეოქიმიური აღწერილობა ირიბად აისახება კალაშემცველ საბადოების ფორმაციულ კლასიფიკაციაში და შემოთავაზებულ იქნა რადკევიჩის მიერ შემდრგი დანამატებით.
- A. კალაშემცველი გრანიტების ფორმაცია. კასიტერიტი დადგენილია გრანიტების აქცესორულ ნაწილში.
- B. იშვიათმეიალური გრანიტების ფორმაცია. ეს გრანიტები არიან ლიტიონიტ-ამაზონიტ-ალბიტური ტიპის (აპოგრანიტები ა. ა. ბეუსუს მიხედვით). კასიტერიტი აქცესორულ ნაწილში კოლუმბიტი-ტატნატლიტითან, მიკროლიტთან ერთად და სხვა.
- C. კალაშემცველი პეგმატიტების ფორმაცია. კალას მინერალიზაციით ხასიათდება Be-Li-, Be-Ta-, F-Li- ტიპებისათვის.
- D. მინდვრის შპატ-კვარც-კასიტერიტის ფორმაცია. გამოყოფილია ი. ფ. გრიგორიევის მიერ. ეს არის კვარც-მინდვრისშპატიანი ძარღვები კასიტერიტთან ერთად და სხვა მინერალებთან.
- E.კვარცო-კასტერიტული ფორმაცია. ეს არის ძარღვული ზონები, გრეიზენები კვარცთან, მუსკოვიტთან, ვოლფრამიტთან, კასიტერიტთან ერთად და სხვა.
- F.კასიტერიტ-სილიკატურ-სულფიდური ფორმაცია ტურმალინური და ქლორიტული ტიპებით.
- G.კასიტერიტ-სულფიდური ფორმაცია. ასევე ძირითადი კალაპროდუქტიული ფორმაცია. მასში გამოყოფენ შემდეგ ძირითად ტიპებს:
- შტოკვერკული კალა-ვოლფრამული საბადოები;
- კვარც-კასიტერიტ-არსენოპირიტული ტიპის მადნური სხეულები;
- პროდუქტიული კვარცული ძარღვები სულფიდურ-კასიტერიტ-ქლორიტული ტიპის;
- H.კალა-სკარნული ფორმაცია.
- J.მერქნული კალას ფორმაცია (რიოლიტური ფორმაცია).
- К.ფუძე და ულტრაფუძიანი ქანების ფორმაცია
- L.უკრაინის ტუტე ქანების ფორმაცია(ვ. ს. მატელიდის მიხედვით, 1988).
წარმოება
[რედაქტირება | წყაროს რედაქტირება]წარმოების პროცესში კალაშემცველი მადანი (კასიტერიტი) განიცდის ნაწილაკებად დაქუცმაცებას რომლებიც ზომით არიან მიახლოებით ~ 10 მმ, (სამრეწველო წისქვილებში), რის შემდეგაც კასიტერიტი თავისი შედარებით მაღალი სიმკვრივის და მასის გამო გამოეყოფა ცარიელ ქანებს ვიბრაციულ-გრავიტაციული მეთოდით გამამდიდრებელ მაგიდებზე. დამატებით კი გამოიყენება მადნის გამდიდრება/გაწმენდის ფლოტაციური მეთოდი.
მიღებულ კალას მადნის კონცენტრატს შემდეგ ადნობენ ღუმელებში. გამოდნობის პროცესში ღდგება თავისუფალ მდგომარეობამდე უშუალოდ ხის ნახშირის გამოყენებით, რომლის ფენებს აგებენ რიგრიგობით მადანთან ერთად.
ფიზიკური და ქიმიური თვისებები
[რედაქტირება | წყაროს რედაქტირება]მარტივი ნივთიერება კალა პოლიმორფულია. ჩვეულებრივ პირობებში ის არსებობს b-მოდიფიკაციის სახით (თეთრი კალა), მდგრადია 13,2 °C-ის მაღლა. თეთრი კალა — ეს მოვერცხლისფრო-თეთრი, რბილი, პლასტიკური ლითონია, რომელსაც ტეტრაგონალური ელემენტარულ უჯრედებიანი მესერი აქვს, პარამეტრებია a = 0.5831, c = 0.3181 ნმ. კალას ყოველი ატომის საკოორდინაციო გარემოცვა — ოქტაედრია. სიმკვრივე b-Sn 7,228 გ/სმ³. დნობის ტემპერატურა 231,9 °C, დუღილის ტემპერატურა 2270 °C.
გაცივებისას, მაგალითად, ყინვისას გარეთ, თეთრი კალა გადადის a-მოდიფიკაციაში (ნაცრისფერი კალა). ნაცრისფერი კალას აქვს ალმასის სტრუქტურა (კუბურ კრისტალური მესერი პარამეტრებით а = 0,6491 ნმ). ნაცრისფერ კალაში ყოველი ატომის საკოორდინაციო პოლიედრი — ტეტრაედრია, საკოორდინაციო რიცხვია 4. ფაზურ გადასვლას b-Sn a-Sn-ში თანხლებს კუთრი მოცულობის ზრდა 25,6 %-ით (სიმკვრივე a-Sn შეადგენს 5,75 გ/სმ³), რაც იწვევს კალას დაშლას ფხვნილად. ძველ დროში ყინვების დროს კალას ნაკეთობების ფხვნილად გარდაქმნას „კალას ჭირს“ უწოდებდნენ. ამ „ჭირის“ შედეგად ფოლაქები მუნდირებზე, რგოლები, კოვზები იშლებოდნენ, და არმიას შეეძლო ბრძოლისუნარიანობის დაკარგვა. (დაწვრილებით „კალას ჭირის“ საინტერესო ფაქტების შესახებ იხილეთ ქვემოთ ნაჩვენებ წყაროზე).
კალას ორი მოდიფიკაციის სტრუქტურების განსხვავების გამო განსხვავდებიან მათი ელექტროფიზიკური თვისებებიც. ასე რომ, b-Sn — ლითონია, ხოლო a-Sn მიეკუთვნება ნახევარგამტარებს. 3,72 К-ის ქვევით a-Sn გადადის ზეგამტარ მდგომარეობაში. სტანდარტული ელექტროდული პოტენციალი E °Sn2+/Sn ტოლია −0.136 ვ, ხოლო E ორთქლის °Sn4+/Sn2+ 0.151 ვ.
ოთახის ტემპერატურისას კალა, ჯგუფში მეზობელის გერმანიუმის მსგავსად, მდგრადია წყლის ან ჰაერის ზემოქმედებისაგან. ასეთი ინერტულობა აიხსნება ზედაპირზე ოქსიდების ფენის წარმოქმნით. კალას შესამჩნევი ჟანგვა ჰაერზე იწყება 150 °C უფრო მაღალი ტემპერატურის დროს:
Sn + O2 = SnO2.
გახურებისას კალა რეაგირებს უმეტეს არალითონებთან. ამასთან წარმოიქმნებიან ნაერთები ჟანგვის ხარისხით +4, რომელიც კალასათვის უფრო დამახასიათებელია, ვიდრე +2. მაგალითად:
Sn + 2Cl2 = SnCl4
კონცენტრირებულ მარილმჟავასთან კალა ნელა რეაგირებს:
Sn + 4HCl = SnCl4 + H2
ასევე შესაძლებელია ქლორკალა მჟავას წარმოქმნა, შემადგენლობით HSnCl3, H2SnCl4 და სხვა, მაგალითად:
Sn + 3HCl = HSnCl3 + 2H2
გაზავებულ გოგირდმჟავაში კალა არ იხსნება, ხოლო კონცენტრირებულთან — რეაგირებს ძალიან ნელა.
კალასა და აზოტმჟავას რეაქციის პროდუქტის შემადგენლობა დამოკიდებულია მჟავას კონცენტრაციაზე. კონცენტრირებულ აზოტმჟავაში წარმოიქმნება კალას მჟავა b-SnO2·nH2O (ზოგჯერ მის ფორმულას წერენ შემდეგნაირად H2SnO3). ამასთან კალა ავლენს არალითონის თვისებებს:
Sn + 4HNO3 конц. = b-SnO2·H2O + 4NO2 + H2O
კალა გაზავებულ აზოტმჟავასთან ურთიერთქმედებისას ავლენს ლითონის თვისებებს. რეაქციის შედეგად წარმოიქმნება მარილი კალას ნიტრატი (II):
3Sn + 8HNO3 разб. = 3Sn(NO3)2 + 2NO + 4H2O.
კალას გახურებისას, ტყვიის მსგავსად, შეუძლია რეაგირება ტუტეების წყლიან ხსნარებთან. ამასთან გამოიყოფა წყალბადი და წარმოიქმნება ჰიდროქსოკომპლექსი Sn (II), მაგალითად:
Sn + 2KOH +2H2O = K2[Sn(OH)4] + H2
კალას ჰიდრიდი — სტანანი SnH4 — შეიძლება მიღებულ იქნას რეაქციით:
SnCl4 + Li[AlH4] = SnH4 + LiCl + AlCl3.
ეს ჰიდრიდი ძალიან არამდგრადია და ნელა იშლება უკვე 0 °C.
კალას პასუხობს ორი ოქსიდი SnO2 (წარმოიქმნება კალას მჟავეების გაუწყლოებისას) და SnO. ბოლო შეიძლება მივიღოთ კალას ჰიდროქსიდის (II) Sn(OH)2 ნელი გაცხელებით ვაკუუმში:
Sn(OH)2 = SnO + H2O
კალას ოქსიდის (II) ძლიერი გახურებით დისპროპორციონირდება:
2SnO = Sn + SnO2
ჰაერზე შენახვისას კალას მონოქსიდი SnO თანდათან იჟანგება:
2SnO + O2 = 2SnO2.
კალას (IV) მარილების ხსნარების ჰიდროლიზის დროს წარმოიქმნება თეთრი ნალექი - ეგერთ წოდებული a-კალას მჟავა:
SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.
H2[Sn(OH)6] = a-SnO2·nH2O + 3H2O.
ახლად მიღებული a-კალას მჟავა იხსნება მჟავებში და ტუტეებში:
a-SnO2·nH2O + KOH = K2[Sn(OH)6],
a-SnO2·nH2O + HNO3 = Sn(NO3)4 + H2O.
შენახვისას a-კალას მჟავა ბერდება, კარგავს წყალს და გადადის b-კალას მჟავაში, რომელიც გამოირჩევა დიდი ქიმიური ინერტულობით. თვისებების ეს ცვლილებებს უკავშირებენ აქტიური HO-Sn დაჯგუფებების რიცხვის შემცირებას, მათი დგომისა და შეცვლაზე უფრო მეტად ინერტული -Sn-O-Sn- კავშირებით.
კალას მარილების ხსნარებზე Sn(II) სულფიდების ხსნარების ზემოქმედებით გამოიყოფა ნალექი კალას სულფიდი(II):
- Sn2+ + S2- = SnS
ეს სულფიდი შეიძლება ადვილად დაიჟანგოს SnS2 მდე, ამონიუმის პოლისულფიდის ხსნარით:
- SnS + (NH4)2S2 = SnS2 + (NH4)2S
წარმოქმნილი დისულფიდი SnS2 იხსნება ამონიუმის სულფიდის (NH4)2S ხსნარში:
SnS2 + (NH4)2S = (NH4)2SnS3.
ოთხვალენტიანი კალა ქმნის კალაორგანული ნაერთების ფართო კლასს, რომელიც გამოიყენება ორგანული სინთეზისას, როგორც პესტიციდები და სხვა.
კალას ჭირი
[რედაქტირება | წყაროს რედაქტირება]13,2 °C ტემპერატურაზე ქვემოთ მიმდინარეობს კალას კუთრი მოცულობის ზრდა 25,6 %-ით, და ის სპონტანურად გადადის სხვა ფაზურ მდგომარეობაში — ნაცრისფერი კალა (α-Sn), კრსტალურ მესერში რომელშიც ატომები განლაგებულნი არიან ნაკლებად მჭიდროდ. ერთი მოდიფიკაცია გადადის სხვაში ისე სწრაფად როგორც უფრო ნაკლებია გარემოს ტემპერატურა. ტემპერატურისას −33 °C გარდაქმნის სიჩქარე მაქსიმალურია. კალა იმსხვრევა და გარდაიქმნება ფხვნილად. ასევე თეთრი და ნაცრისფერი კალას ურთიერთშეხებისას ხდება უკანასკნელის „დასნეულება“. ამ მოვლენების ერთიანობას უწოდებენ „კალას ჭირს“. ამ ფაზური გადასვლის მეცნიერული შესწავლა დაიწყეს 1870 წ. პეტერბურგელი მეცნიერის ი. ფრიცშეს მიერ. დადგენილია რომ, ეს პროცესი არის თეთრი კალას ალოტრიპული გარდაქმნა ნაცრისფერ კალად, ალმასის ტიპის სტრუქტურით.
თეთრი კალა — მოვერცხლისფრო-თეთრი, ბზინვარე ლითონია სპეციფიკური ტეტრაგონალური სტრუქტურით და ელექტრონული s2p2-მდგომარეობით — β-ფაზით. ნაცრისფერი კალა — კოვალენტური კრისტალი ალმასის სტრუქტურით და ელექტრონული sp3-მდგომარეობით — α-ფაზით. კალას ფაზურ გადასვლას თეთრიდან ნაცრისფერში და უკუ თან ახლავს ელექტრო სტრუქტურის გარდაქმნით და ძლიერი (26,6 %) მოცულობითი ეფექტი. თეთრი კალა შეიძლება გაცივებულ იქნას გელურ ტემპერატურამდე (ფაზური α-β-წონასწორობის ტემპერატურა მიახლოებით არის +13,2 °C).
ლიტერატურაში გვხვდება მითითება, იმაზე რომ კალა რომელიც სინჯარაში ხვდება, სადაც ოდესმე იყო საინფექციო ნივთიერება, „დასნებოვნდება“! ნაჩვენებია ექსპერიმენტალურად, რომ თუ რამდენიმე დღეღამით (ოთახის ტემპერატურის დროსაც) მინაზე დავდებთ InSb კრისტალს, მისი აღების შემდეგ ის ინარჩუნებს „მეხსიერებაში“ მის იქ ყოფნას. ეს მინა „ასნეულებს“ თეთრი კალას ნიმუშს. მაგრამ არა უცებ, არამედ რამდენიმე დღის შემდეგ. და არა 100 %-ით ალბათობით. მინის ტემპერატურის მომატებასთან ერთად მკვეთრად იზრდება „ინკუბაციის პერიოდი“ და ეცემა „დასნებოვნების“ ალბათობა. ფირფიტის გარეცხვა წყლით, სპირტით და სხვა წყლის მშთანთქავი ნივთიერებებით ასევე „შლიან“ ამ „მეხსიერებას“. არსებობს ასევე კიდევ ერთი კარგი მოვლენა, დამახასიათებელი „კალას ჭირისათვის“, — ესაა თეთრი კალას „მეხსიერება“ იმის შესახებ რომ, ის ოდესღაც გადადიოდა ნაცრისფერში. ი. ფრიცშემ ჯერ კიდევ 1870 წ. შენიშნა რომ, თეთრი კალა, მიღებული ნაცრისფერი კალას გახურებით, მეორეჯერ გაცივებისას ნაცრისფერ კალად უფრო ადვილად გარდაიქმნება, ვიდრე პირველად. ნიმუში თითქოსდა „იხსენებს“ წინარეისტორიას, რის გამოც ეს მოვლენა, საკმაოდ ფართოდაა ცნობილი, ჩვეულებრივ მას უწოდებენ „მეხსიერებას“. კოენმა „კალას ჭირის“ ერთ-ერთი ნიშნად მიიჩნია კალას „გაფუჭება“ „გამოჯანმრთელების“ შემდეგ[14].
ერთ-ერთი შესაძლებლობას „კალას ჭირის“ თავიდან ასაცილებლად წარმოედგენს კალას შემადგენლობაში სტაბილიზატორების დამატება, მაგალითად ბისმუტის.
საინტერესო ფაქტები:
- „კალას ჭირი“ — რობერტ ფოლკონ სკოტის სამხრეთ პოლუსის ექსპედიციის დაღუპვის ერთ-ერთი მიზეზი იყო 1912 წ. ის დარჩა საწვავის გარეშე, იმიტომ რომ, ის დაიღვარა კალათი მირჩილული ავზებიდან, რომლებმაც „კალას ჭირი“ განიცადეს, ასე უწოდა მას კოენმა 1911 წ.
- ზოგი ისტორიკოსი მიანიშნებს „კალას ჭირზე“ როგორც ნაპოლეონის არმიის დამარცხების ერთ-ერთ გარემოებაზე რუსეთში 1812 წ. — ძლიერი ყინვებმა კალას ნივთები აქცია ფხვნილად.
- „კალას ჭირმა“ გაანადგურა ბევრი ძვირადღირებული კალას ჯარისკაცების კოლექციები. მაგალითად, პეტერბურგის ალექს. სუვოროვის მუზეუმის რეზერვში არსებული ფიგურები გარდაიქმნენ ფხვნილად — ისინი ინახებოდნენ სარდაფში სადაც ზამთარში გათბობის ბატარეები დასკდა.
გამოყენება
[რედაქტირება | წყაროს რედაქტირება]- კალა გამოიყენება ძირითადად როგორც უსაფრთხო, არატოქსიკური, კოროზიამდგრადი საფარი სუფთა სახით ან სხვა ლითონებთან შენადნობში. კალას მთავარი სამრეწველო გამოყენება ხდება — თეთრი თუნუქის წარმოებაში (მოკალული რკინა) კვების პროდუქტების ტარის დასამზადებლად, რჩილვაში ელექტრონიკაში, სახლის მილსადენებში, მზიდების შენადნობებში და კალას საფარებისათვის. კალას ყველაზე მნიშვნელოვანი შენადნობია — ბრინჯაო (სპილენძთან). შემდეგი ცნობილი შენადნობია — პიუტერი — გამოიყენება ჭურჭლეულის დასამზადებლად. ბოლო დროს ღორძინდება ლითონის გამოყენებისადმი ინტერესი, რადგანაც ის ყველაზე „ეკოლოგიურია“ ფერად ლითონებს შორის. გამოიყენება ზეგამტარი სადენების შესაქმნელად ინტერლითონური ნაერთების საფუძველზე Nb3Sn.
- ლითონურ კალაზე ღირებულება 2006 წ. შეადგენდა საშუალოდ 12—18 დოლ/კგ, მაღალი სიწმინდის კალას ორჟანგი მიახლოებით 25 დოლ/კგ, განსაკუთრებული სიწმინდის მონოკრისტალური კალა მიახლოებით 210 დოლ/კგ.
- კალასა და ცირკონიუმის ინტერლითონიდურ შენაერთებს აქვთ მაღალი დნობის ტემპერატურა (2000 °C) და ჟანგვისადმი მდგრადობა ჰაერზე გახურებისას და გამოიყენებიან მთელი რიგი მიმართულებებით.
- კალა წარმოადგენს ლეგირების მნიშვნელოვან კომპონენტს კონსტრუქციული შენადნობების მიღებისას ტიტანთან.
- კალას ორჟანგი — ძალიან ეფექტიანი აბრაზიული მასალაა, რომელიც გამოიყენება ოპტიკური მინის ზედაპირის დასამუშავებლად.
- კალას მარილების ნარევები — „ყვითელი კომპოზიცია“ — ადრე გამოიყენებოდა როგორც შალის საღებავი.
- კალა ასევე გამოიყენება დენის ქიმიურ წყაროებში ანოდის სახით, მაგალითად: მანგანუმ-კალას ელემენტი. პერსპექტიულია კალას გამოყენება ტყვია-კალას აკუმულატორებში; ასე მაგალითად, ტოლი ძაბვისას, ტყვიის აკუმულატორებთან შედარებით ტყვია-კალას აკუმულატორს აქვს 2,5-ჯერ მეტი ტევადობა და 5-ჯერ მეტი ენერგოსიმკვრივე მოცულობის ერთეულზე, მისი შიდა წინააღმდეგობა მნიშვნელოვნად დაბალია.
კალას ჯარისკაცების მასიური გამოჩენა როგორც სათამაშო განეკუთვნება XVI ს., როდესაც ნიუნბერგის მცხოვრებმა ერნსტ ჰენრიხსენმა საფუძველი ჩაუყარა სათამაშო ფიგურების დამზადებას გარკვეული მასშტაბით. კალა კი როგორც მასალა გამოიყენეს XVIII ს-ნის ბოლოს, მის შემდეგ როდესაც გაჩნდა იაფი ფაიანსის ჭურჭელი, და ბევრი ჩამომსხმელი, რომლებმაც დაკარგეს შეკვეთები სასადილო ჭურჭლეულზე, გადაერთვენ კალას ჯარისკაცების და მინიატურების წარმოებაზე.
გერმანიის იმპერიის გაჩენის შემდეგ ბაზარი აავსო პრუსიის არმიის ყველა ეპოქის ჯარისკაცების ფიგურებმა. როგორ არ გამოსახავდნენ მათ: აღლუმზე, ლაშქრობაზე, ბრძოლაში. პირველი მსოფლიო ომის დროს გამოჩნდა სხვადასხვაგვარი აქსესუარები: საარტილერიო ქვემეხები, სატვირთო მანქანები, სამხედრო ხომალდები და სხვა.
იზოტოპები
[რედაქტირება | წყაროს რედაქტირება]ბუნებრივი კალა შედგება ათი სტაბილური ნუკლიდისაგან მასური რიცხვით 112 (ნარევში წონის 0,96 %), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) და 124Sn (5,94 %). ამ ელემენტს გააჩნია ყველაზე მეტი რაოდენობის სტაბილური იზოტოპები, რაც დაკავშირებულია იმ ფაქტთან რომ, 50 (კალას ბირთვის პროტონების რიცხვი) წარმოადგენს მაგიურ რიცხვს — ის ქმნის შევსებულ მჭიდრო გარსს ბირთვში და ამით ამაღლებს კავშირის ენერგიას და ბირთვის სტაბილურობას.
კალას იზოტოპები 117Sn და 119Sn არიან მიოსბაუერის იზოტოპები და გამოიყენება გამა-რეზონანსულ სპექტროსკოპიაში.
ფიზიოლოგიური მოქმედება
[რედაქტირება | წყაროს რედაქტირება]ლითონური კალა არატოქსიკურია, რაც იძლევა საშუალებას ის გამოყენებულ იქნას კვების მრეწველობაში. მავნე მინარევები, რომელსაც შეიცავს კალა შენახვისა და გამოყენების ჩვეულებრივ პირობებში, მათ შორის შენადნობებში 600 °С-მდე, არ გამოიყოფიან სამუშაო ზონის ჰაერში, ზღვრულ დასაშვებ ნორმაზე მეტი ვიდრე გათვალისწინებულია სახ. სტანდარტით. დიდი ხნის განმავლობაში (15—20 წლის განმ.) კალას მტვრის ზემოქმედება იწვევს ფილტვებზე ფიბროგენულ ზემოქმედებას და შეიძლება გამოიწვიოს პნევმოკონიოზით დაავადება.
გამოსახულებათა გალერეა
[რედაქტირება | წყაროს რედაქტირება]-
α и β კალა
-
კალას კუბი
-
კალას მადანი
-
კალას საფარიანი კონსერვის ქილა
-
კალას ჯარისკაცი ფორმაში ჩამოსხმის შემდეგ
-
კასიტერიტის მწვრილი დაწინწკ. კვარც-ტოპაზის ჭრილი პოლარიზებულ სინათლეში. გამოსახულების სიფართეა 3,3 მმ.
-
კასიტერის კრისტალი (მუქი)
რესურსები ინტერნეტში
[რედაქტირება | წყაროს რედაქტირება]- WebElements.com – კალა
- ლითონების მონაცემთა ბაზა: კალა დაარქივებული 2012-07-12 საიტზე Wayback Machine.
სქოლიო
[რედაქტირება | წყაროს რედაქტირება]- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 154
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 5, თბ., 1980. — გვ. 325.
- ↑ ნუმიზმატისა და ბონისტის განმარტებითი ლექსიკონი. დაარქივებულია ორიგინალიდან — 2010-11-29. ციტირების თარიღი: 2010-08-30.
- ↑ ლ. ა. ვვედენსკაია, ნ. პ. კოლესნიკოვი. ეტიმოლოგია: სახელმძღვანელო // სპბ.: პიტერ, 2004, ფ. 122.
- ↑ ვოიტკევიჩი გ. ვ., მიროშნიკოვი ა. ე., პოვარენიხი ა. ს. გეოქიმიის მოკლე ცნობარი. მ.: ნედრა, 1970
- ↑ 6.0 6.1 ბარსუკოვი ვ. ლ. და სხვა კალას გეოქიმიის ძირითადი ნიშნები. მ.: მეცნიერება, 1974.
- ↑ ერემეევი ნ. ვ. და სხვა. ცენტრალური ალდანას თვითნაბადი ელემენტები.//მოხსენება სსრკ-ს მა, 1988, 303, 6, ფ.1464 — 1467
- ↑ თვითნაბადი მინერალწარმოქმნა მაგმატიკურ პროცესებში. ნაწილი I და II. იაკუტსკი, 1981
- ↑ კრილოვა ვ. ვ. და სხვა კალა, ტყვია და ინტერლითონური ნაერთები ოქრო-ვერცხლიანი ფორმაციის მადნებში./ЦНИГРИ ნაშრომები, 1979, ტ.142, ფ.22 — 28
- ↑ ნეკრასოვი ი. ი. კალა-შემცველი სისტემების ფაზური შეფარდება. მ.: მეცნიერება, 1976
- ↑ გოვოროვი ი. ნ. პრიმორიის მადნეულის რაიონების გეოქიმია. მ.: მეცნიერება, 1977
- ↑ ნეკრასოვი ი. ი. კალას-შემცველი სისტემების ფაზური შეფარდება მ.: მეცნიერება, 1976
- ↑ ნეკრასოვი ი. ი. კალა მაგმატიკურ და პოსტმაგმატიკურ პროცესებში. მ.: მეცნიერება, 1874.
- ↑ სტირკასი ა. დ. ბუნება, 1996, № 11. დაარქივებულია ორიგინალიდან — 2010-04-07. ციტირების თარიღი: 2010-11-27.
| ქიმიურ ელემენტთა პერიოდული სისტემა | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| 8 | 119 | 120 | ⁂ | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 | ||||||||||
| ⁂ | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||




















