Fenile

Il fenile in chimica organica è il gruppo funzionale derivato dal benzene, il capostipite degli idrocarburi aromatici, per rimozione di un atomo di idrogeno, la cui formula chimica è C6H5–.[1] Il fenile è quindi un arile,[2] un gruppo funzionale aromatico, e il suo simbolo, spesso usato nelle formule e in schemi di reazione, è Ph[3] o anche, a volte, φ o Φ.[4]
Nel gruppo fenile sono presenti sei atomi di carbonio legati tra loro in un anello esagonale planare con legami doppi alternati a legami singoli; cinque di questi atomi di C sono legati esternamente a un singolo atomo di idrogeno, con il restante carbonio legato al sostituente. Vista la frequente presenza nei composti naturali e di sintesi, il gruppo fenile è estremamente comune in chimica organica.[5][6]
Il gruppo fenile, come per gli arili in genere, si lega al resto della molecola di cui fa parte con un carbonio dell'anello benzenico, quindi con un C ibridato sp2, a differenza degli alchili, che si legano con un C ibridato sp3.
Etimologia e nomenclatura
[modifica | modifica wikitesto]Il termine «fenile», come pure i suoi simboli (Ph, φ, Φ[7]), deriva da 'phene' (fene),[8] seguíto dal suffisso -ile che si dà in generale ai gruppi funzionali. Questo era l'altro nome del benzene, diffuso nell'Ottocento, la cui radice fen- è presente in fenolo (C6H5–OH), fenato (C6H5–O–), ma anche in tiofene, selenofene, fenilio (C6H5+[9]), fenonio (intermedio cationico del fenilio a ponte[10]), ed altro.[8][11]
Il termine phene venne coniato dal chimico francese Auguste Laurent dal verbo greco φαίνω (phàino), illumino,[12] dato che nell'olio illuminante sono presenti prevalentemente gli idrocarburi aromatici[11] e che le loro fiamme sono luminose, mediamente più di quelle del metano o degli idrocarburi alifatici in genere; questo anche in ricordo della scoperta del benzene da parte del notevole fisico sperimentale Michael Faraday nel 1825 nei residui oleosi lasciati dal gas illuminante nei lampioni di Londra.[13] Da questo termine sono stati ricavati il francese phényle,[8] quindi l'inglese phenyl e l'italiano fenile (questo dal 1869).[14]
Il fenile è parte di altri gruppi funzionali che hanno nomi che possono generare disorientamento. Il benzile (C6H5-CH2– o anche Ph-CH2–, simbolo Bn),[15][16] il cui nome deriva direttamente da 'benzene': è un gruppo che contiene un fenile ma che, a differenza di quest'ultimo, non è un arile,[17] non essendo l'idrogeno rimosso quello dell'anello benzenico; inoltre, il benzile non va poi confuso con il benzoile (C6H5-CO–, simbolo Bz), che è un acile che contiene anch'esso un fenile (Ph-CO–).
Il fenile è significativamente presente in molti derivati principali del benzene: il fenolo può essere rappresentato Ph–OH (o semplicemente PhOH), il clorobenzene Ph–Cl (PhCl), il nitrobenzene Ph–NO2 (PhNO2), il toluene Ph–CH3 (PhCH3), l'acido benzoico Ph–COOH (PhCOOH), l'acetofenone e il benzofenone[18] Ph–COCH3 e Ph–CO–Ph (o Ph2CO) e a volte il benzene stesso viene scritto PhH in tabelle.[19]
Il vecchio nome phene del benzene è a volte ancora riportato.[20]
Specie chimiche derivate dal fenile
[modifica | modifica wikitesto]Dal gruppo funzionale fenile derivano specie chimiche (o entità molecolari) aventi la stessa composizione chimica C6H5. Queste sono il catione fenile o fenilio (C6H5+, già menzionato sopra),[9] il radicale fenile (C6H5•) e l'anione fenile o ione feniluro[21] (C6H5−). Il catione e l'anione possono derivare dal radicale fenile per rimozione o aggiunta di un elettrone, rispettivamente. Da notare che n questo caso la carica positiva o negativa, come pure l'elettrone spaiato, non sono delocalizzati sull'anello benzenico;[22] questo a differenza di quanto avviene nel caso del benzile (PhCH2+•–).
Catione fenile (fenilio)
[modifica | modifica wikitesto]La formazione di C6H5+ dal radicale C6H5• costa un'energia notevole, pari al potenziale di ionizzazione di quest'ultimo, che è di 8,32 eV (803 kJ/mol).[23] La struttura di questo ione molecolare si discosta da quella dell'anello benzenico in quanto il carbonio che porta la carica positiva dovrebbe essere ibridato sp (invece di sp2), dovendo fare solo due legami sigma, il che comporta un allargamento dell'angolo di legame, compatibilmente con il mantenimento della chiusura dell'anello. In effetti, per l'angolo C-C+-C nel fenilio, generato in fase gassosa, si trova il valore di 147°.[24]
Può essere ottenuto in fase gassosa, ma anche in fase condensata, a partire da benzeni triziati;[25] il decadimento beta dell'atomo di trizio in un gruppo C–T dell'anello comporta l'espulsione di un elettrone e la sua trasformazione in un atomo di elio positivo, dopodiché il legame C–He+ si rompe eteroliticamente con allontanamento di He neutro, lasciando la carica positiva su C; in tal modo si ha quindi la formazione del carbocatione localizzato (ione fenilio) altamente reattivo:[26] la cattura di un elettrone da parte del fenilio (a dare il radicale neutro) comporta un guadagno di stabilità pari a 8,32 eV (802,8 kJ/mol).[23] Con il protossido di azoto N2O reagisce da acido di Lewis dando inizialmente l'addotto [PhONN]+, che poi rilascia velocemente una molecola di azoto formando [PhO]+.[27]
Il fenilio è un elettrofilo, un acido di Lewis e un ossidante, in quanto catturatore di un elettrone.[27] In fase gassosa le sue reazioni con vari substrati consistono nell'estrazione di un elettrone da un'altra specie con la formazione del radicale fenile (C6H5•, o anche Ph•), che poi innesca diversi canali di reazione radicalici.[28] In fase condensata reagisce comportandosi da elettrofilo verso substrati aromatici, operando su di essi principalmente sostituzioni elettrofile aromatiche.[26]
Radicale fenile
[modifica | modifica wikitesto]Il radicale fenile C6H5• può essere generato dalla decomposizione spontanea del radicale benzoilossi C6H5-COO• che si frammenta eliminando CO2. Questo radicale, a sua volta, si produce per riscaldamento del perossido di benzoile C6H5-COO–OOC-C6H5, un noto iniziatore radicalico.[29] Può essere generato anche dalla decomposizione di azocomposti asimmetrici opportuni, come Ph-N=N-CPh3: qui, con l'espulsione di una molecola di N2, la formazione del radicale fenile è favorita perché accompagnata da quella del radicale stabile trifenilmetile:[30]
Ph-N=N-CPh3 → C6H5• + •CPh3
Il radicale fenile reagisce con il tetracloruro di carbonio estraendo da esso un atomo di cloro (Cl•), formando il clorobenzene e lasciando un radicale triclorometile:[31]
C6H5• + CCl4 → C6H5-Cl + •CCl3
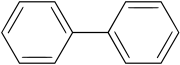
Il dimero del radicale stesso è il bifenile C6H5–C6H5, l'idrocarburo aromatico avente la molecola formata da due anelli benzenici uniti per un legame C–C tra i due anelli.[32] Nella produzione del radicale fenile o nelle sue reazioni in cui esso è coinvolto un (sotto)prodotto da tener sempre presente è proprio il bifenile.
Anione fenile (feniluro)
[modifica | modifica wikitesto]L'anione fenile è un anione aromatico con la carica negativa che risiede su un carbonio sp2; si può formare dal radicale fenile per aggiunta di un elettrone; la trasformazione, che corrisponde energeticamente all'affinità elettronica del radicale, è esotermica e restituisce 1,0960 ± 0,0060 eV (105,75 ± 0,58 kJ/mol).[33]
Oltre che per acquisizione di elettrone dal radicale, lo ione feniluro si può ottenere per sottrazione di un protone (H+) dal benzene; questa operazione può essere condotta in fase gassosa o in soluzione.
In fase gassosa la deprotonazione del benzene produce l'anione fenile:
C6H6 → C6H5− + H+
Il costo energetico della trasformazione è pari a 1.678,7 ± 2,1 kJ/mol ed è uguale per definizione all'affinità protonica del feniluro.[34] Questo valore è alto perché il benzene è un acido debolissimo e quindi il feniluro è una base molto forte; è però alquanto meno forte del metiluro, dove la carica risiede su un C sp3, per il quale metiluro l'affinità protonica è di 1.712 kJ/mol.[35]
In soluzione, il pKa per la deprotonazione del benzene (Ph−H + solv. → Ph– + solv.H+) è riportato come 43; al confronto, per il metano si ha pKa = 48, e quindi, in soluzione, il feniluro come base è (circa) 100.000 volte più debole del metiluro.[36]
Specie molecolari che si avvicinano alla situazione elettronica del feniluro sono il fenillitio (C6H5Li), il fenilsodio (C6H5Na) e simili; in misura un po' minore i reattivi di Grignard contenenti un fenile, tipo il bromuro di fenilmagnesio (C6H5MgBr) e lo ioduro di fenilmagnesio (C6H5MgI). In presenza di opportuni solventi eterei entrambi i tipi di reattivi, contenenti un Cδ−, si comportano come carbanioni particolarmente nucleofili, capaci di attaccare un Cδ+ di un alogenuro alchilico RX (sostituzione nucleofila SN2) o di un carbonile R2CO (addizione nucleofila al carbonile) per formare legami C−C e allungare la catena.
Struttura, legami e caratterizzazione
[modifica | modifica wikitesto]Riguardo alle sue proprietà elettroniche, il gruppo fenile, che si lega tramite un C sp2 similmente al un gruppo vinile, è considerato un gruppo elettronattrattore, avente un effetto induttivo −I. Questo a causa dell'aumento dell'elettronegatività che si ha passando da un C sp3 di un alchile al C sp2 del fenile e, in ultima analisi, per l'aumento del carattere s dell'orbitale ibrido in quest'ultimo caso.[37]
Quando però c'è coniugazione con un atomo o gruppo elettron attrattore (effetto mesomero −M) al quale esso è unito, il fenile può fungere da gruppo elettrondonatore per effetto di risonanza (effetto mesomero +M), grazie alla capacità del suo sistema π di donare densità elettronica.[38] Se viceversa al fenile è unito un gruppo con effetto mesomero +M di sufficiente entità, allora il fenile si mostrerà elettronattrattore, come accade quando esso è legato ad atomi con doppietti liberi, come -OH (fenolo) e -NH2 (anilina).
Il gruppo fenile in una molecola contribuisce a renderla idrofobica. I gruppi fenile tendono a resistere all'ossidazione e alla riduzione e, come tutti i composti aromatici, hanno una stabilità maggiore rispetto ai gruppi alifatici (non aromatici). Questa maggiore stabilità è dovuta alla particolare azione stabilizzatrice del sestetto elettronico che occupa i soli tre orbitali molecolari leganti del sistema π del benzene,[39] stabilità che è alla base del concetto di aromaticità.[6]
Le lunghezze dei legami tra gli atomi di carbonio in un gruppo fenile sono approssimativamente di 140 pm (1,40 Å),[40] valore intermedio tra quella nell'etano (153,6 pm[41]) e quella nell'etene (133,9 pm[42]).
Nella spettroscopia di risonanza magnetica nucleare 1H-RMN, i protoni del gruppo fenile mostrano tipicamente spostamenti chimici (chemical shifts) che cadono a cavallo di 7,27 ppm (il valore per il benzene), che possono però variare in certa misura in base ai sostituenti presenti. Questo è dovuto alla corrente d'anello presente nei composti aromatici, che ha un'azione schermante sui protoni dell'anello stesso.[43]
Proprietà ed occorrenza
[modifica | modifica wikitesto]I gruppi fenile sono solitamente introdotti utilizzando reagenti che si comportano come fonti dell'anione fenile o del catione fenile. Il fenillitio (C6H5Li) e il bromuro di fenilmagnesio (C6H5MgBr) sono esempi di reagenti utilizzati per introdurre l'anione fenile.[44]
Il benzene si comporta da nucleofilo nei confronti di adatti elettrofili, dai quali viene attaccato per dare intermedi che sono cationi cicloesadienilici coniugati, con carica positiva delocalizzata, e quindi cationi stabilizzati per risonanza,[4] da non confondersi con il catione fenilio, cationi cicloesadienilici che poi trasferiscono un protone ad un anione presente che funge da base, fornendo così il prodotto di sostituzione:
con E+ che rappresenta la specie "elettrofila" come ad esempio Cl+, NO2+, SO3. Queste reazioni sono le sostituzioni elettrofile aromatiche.
- Composti rappresentativi contenenti gruppi fenile
-
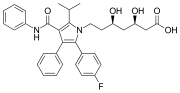
Atorvastatina (Torvast), un farmaco contenente due gruppi fenile e un gruppo p-fluorofenile. Si utilizza per abbassare i livelli di colesterolo nelle persone affette da ipercolesterolemia.
-
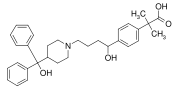
Fexofenadina, farmaco antistaminico utilizzato nel trattamento di allergie contenente due gruppi fenile e un gruppo p-fenilene (-C6H4-).
-
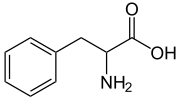
Fenilalanina, amminoacido comune.
-
Bifenile, formato da due gruppi fenile connessi da un legame semplice C-C.
-
Clorobenzene (o fenilcloruro), solvente.
I gruppi fenile si trovano in molti composti organici, sia naturali che sintetici (vedi figura). Uno dei più comuni prodotti naturali contenenti un gruppo fenile è l'amminoacido fenilalanina. Il polimero polistirene è derivato dallo stirene, un monomero contenente il fenile e deve le sue proprietà alla rigidità e idrofobicità dei gruppi fenile in esso presenti. Molti farmaci e numerose sostanze inquinanti contengono gruppi fenile.
Uno dei composti più semplici contenenti fenile è il fenolo, (C6H5OH). Si è dimostrato che la stabilità data dalla risonanza del gruppo fenile nel fenolo lo renda un acido più forte rispetto agli alcoli alifatici come l'etanolo (pKa = 10 contro pKa = 16–18), in aggiunta al contributo significativo dato dalla maggiore elettronegatività del carbonio α sp2 nel fenolo rispetto al carbonio α sp3 negli alcoli alifatici.[45]
Note
[modifica | modifica wikitesto]- ^ R. Fusco, G. Bianchetti e V. Rosnati, CHIMICA ORGANICA, volume primo, L. G. Guadagni, 1974, p. 45.
- ^ The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - arenes (A00435), su goldbook.iupac.org. URL consultato il 12 ottobre 2024.
- ^ Da non confondere con pH, simbolo di -log10(aH+).
- ^ a b J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, p. 98.
- ^ Jerry March, Advanced organic chemistry: reactions, mechanisms, and structure, 4ª ed., New York, Wiley, 1992, ISBN 978-0-471-60180-7.
- ^ a b Aromaticity. Benzene and Other Aromatic Compounds, in Virtual Textbook of Organic Chemistry, Michigan State University.
- ^ I simboli «φ, Φ» sono le forme minuscola e maiuscola della lettera (phi) che nell'alfabeto greco corrispondono a «f, F»; la traslitterazione è proprio «ph».
- ^ a b c Didier Astruc, Ed., Arene Chemistry : From Historical Notes to the State of the Art, in Modern Arene Chemistry, WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2002, pp. 4-5, ISBN 3-527-30489-4.
- ^ a b (EN) Maurizio Speranza, Michael D. Sefcik e Jay M. S. Henis, Phenylium (C6H5+) ion-molecule reactions studied by ion cyclotron resonance spectroscopy, in Journal of the American Chemical Society, vol. 99, n. 17, 1977-08, pp. 5583–5589, DOI:10.1021/ja00459a008. URL consultato il 22 ottobre 2020.
- ^ F. A. CAREY e R. J. SUNDBERG, Advanced Organic Chemistry, 5ª ed., Springer Science+Business Media, LLC, 2007, p. 423, ISBN 978-0-387-68346-1.
- ^ a b Etimologia : fenile;, su etimo.it. URL consultato il 24 luglio 2020.
- ^ (EN) Olivetti Media Communication-Enrico Olivetti, DIZIONARIO GRECO ANTICO - Greco antico - Italiano, su grecoantico.com. URL consultato il 22 ottobre 2024.
- ^ John McMurry, Organic chemistry, 8e, Brooks/Cole, Cengage Learning, 2012, p. 536, ISBN 978-0-8400-5444-9.
- ^ Fenile > significato - Dizionario italiano De Mauro, su Internazionale. URL consultato il 23 ottobre 2024.
- ^ Michael Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, John Wiley, 2020, p. XXV, ISBN 978-1-119-37179-3.
- ^ Da non confondere con benzoile (Bz).
- ^ A differenza dell'isomero strutturale tolile (CH3-C6H4–).
- ^ Anche all'interno di questi nomi compare "fen(e)".
- ^ (EN) The Phenyl Group, su Chemistry LibreTexts, 2 ottobre 2013. URL consultato il 23 ottobre 2024.
- ^ Lane C. Sander e Stephen A. Wise, Polycyclic Aromatic Hydrocarbon Structure Index (PDF), in NIST Special Publication 922, Dicembre 1997.
- ^ Da non confondere con il fenato (o fenossido), che è C6H5–O–.
- ^ Michael Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, John Wiley, 2020, pp. 230-231, ISBN 978-1-119-37179-3.
- ^ a b Phenyl radical, su webbook.nist.gov.
- ^ (EN) Sandra D. Wiersma, Alessandra Candian e Joost M. Bakker, IR photofragmentation of the phenyl cation: spectroscopy and fragmentation pathways, in Physical Chemistry Chemical Physics, vol. 23, n. 7, 25 febbraio 2021, pp. 4334–4343, DOI:10.1039/D0CP05554A. URL consultato il 23 ottobre 2024.
- ^ N. E Shchepina, V. D Nefedov e M. A Toropova, Ion-molecular reactions of free phenylium ions, generated by tritium β-decay with bidentate arenes, in Tetrahedron Letters, vol. 41, n. 1, 1º gennaio 2000, pp. 25–27, DOI:10.1016/S0040-4039(99)02019-5. URL consultato il 3 novembre 2024.
- ^ a b (EN) Antonello Filippi, Giorgio Occhiucci e Maurizio Speranza, Gas-phase heteroaromatic substitution. 10. Reaction of free phenylium ion with simple five-membered heteroarenes in the gaseous and liquid phase, in Canadian Journal of Chemistry, vol. 69, n. 4, 1º aprile 1991, pp. 732–739, DOI:10.1139/v91-108. URL consultato il 23 ottobre 2024.
- ^ a b Anna Giordana, Giovanni Ghigo e Glauco Tonachini, The reaction of N2O with phenylium ions C6(H,D)5+: An integrated experimental and theoretical mechanistic study, in The Journal of Chemical Physics, vol. 131, n. 2, 10 luglio 2009, DOI:10.1063/1.3148366. URL consultato il 3 novembre 2024.
- ^ (EN) Shengjun Yao, Xiang Zhang e Jing Zhou, Electrophilic aromatic substitution and single‐electron transfer (SET) by the phenylium ion in the gas phase: characterization of a long‐lived SET intermediate, in Journal of Mass Spectrometry, vol. 44, n. 1, 2009-01, pp. 32–39, DOI:10.1002/jms.1467. URL consultato il 3 novembre 2024.
- ^ John McMurry, Organic chemistry, 8e, Brooks/Cole, Cengage Learning, 2012, p. 1243, ISBN 978-0-8400-5444-9.
- ^ Francis A. Carey e Richard J. Sundberg, Advanced organic chemistry, 5th ed, Springer, 2007, p. 978, ISBN 978-0-387-44897-8.
- ^ Francis A. Carey e Richard J. Sundberg, Advanced organic chemistry, 5th ed, Springer, 2007, p. 999, ISBN 978-0-387-44897-8.
- ^ I. L. Finar, ORGANIC CHEMISTRY The fundamental principles, Fourth Edition, Longmans, 1963, pp. 697-698.
- ^ Robert F. Gunion, Mary K. Gilles e Mark L. Polak, Ultraviolet photoelectron spectroscopy of the phenide, benzyl and phenoxide anions, with ab initio calculations, in International Journal of Mass Spectrometry and Ion Processes, vol. 117, 1º settembre 1992, pp. 601–620, DOI:10.1016/0168-1176(92)80115-H. URL consultato il 23 ottobre 2024.
- ^ (EN) Gustavo E. Davico, Veronica M. Bierbaum e Charles H. DePuy, The C-H Bond Energy of Benzene, in Journal of the American Chemical Society, vol. 117, n. 9, 1995-03, pp. 2590–2599, DOI:10.1021/ja00114a023. URL consultato il 9 novembre 2024.
- ^ (EN) Methyl radical, su webbook.nist.gov. URL consultato il 14 agosto 2021.
- ^ D. H. Ripin e D. A. Evans, pKa's of C-H bonds in Hydrocarbons and Carbonyl Compounds (PDF), su ccc.chem.pitt.edu.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, p. 203, ISBN 88-299-1470-3.
- ^ Corwin. Hansch, A. Leo e R. W. Taft, A survey of Hammett substituent constants and resonance and field parameters, in Chemical Reviews, vol. 91, n. 2, 1º marzo 1991, pp. 165–195, DOI:10.1021/cr00002a004, ISSN 0009-2665.
- ^ K. F. Purcell e J. C. Kotz, Inorganic Chenistry, Saunders, 1977, p. 159, ISBN 9780721674070.
- ^ Hendrik F. Hameka, Computation of the structures of the phenyl and benzyl radicals with the UHF method, in The Journal of Organic Chemistry, vol. 52, n. 22, 1987, pp. 5025–5026, DOI:10.1021/jo00231a035, ISSN 0022-3263.
- ^ Experimental data for C2H6 (Ethane), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ Experimental data for C2H4 (Ethylene), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ W. H. Brown, B. L. Iverson e E. Anslyn, Organic Chemistry, 8ª ed., Cengage, 2018, p. 572, ISBN 978-1-305-58035-0, LCCN 2016952760.
- ^ Michael Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, John Wiley, 2020, p. 248, ISBN 978-1-119-37179-3.
- ^ Pedro Jorge Silva, Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens, in The Journal of Organic Chemistry, vol. 74, n. 2, 2009, pp. 914–916, DOI:10.1021/jo8018736, ISSN 0022-3263, PMID 19053615.