Guanozin-difoszfát
| Guanozin-difoszfát | |||
| |||
| |||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 146-91-8 | ||
| PubChem | 730 | ||
| ChemSpider | 8630 | ||
| ChEBI | 17552 | ||
| |||
| InChIKey | QGWNDRXFNXRZMB-UUOKFMHZSA-N | ||
| UNII | HLJ737P865 | ||
| ChEMBL | 384759 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C10H15N5O11P2 | ||
| Moláris tömeg | 443,20 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
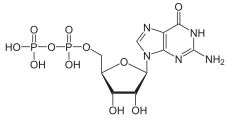
A guanozin-difoszfát, röviden GDP nukleozid-difoszfát. A difoszforsav guanozinnal alkotott észtere. Difoszfátcsoportból, ribózból és guaninból áll.[1]
A GDP-t a GTPázok, például a sejtkommunikációban fontos G-proteinek a guanozin-trifoszfát (GTP) defoszforilációjával állítják elő. A GDP-t a piruvát-kináz a foszfoenolpiruvát révén alakítja GTP-vé.
Keletkezés
[szerkesztés]GTP hidrolízise GDP-vé
[szerkesztés]A GTP GDP-vé való hidrolízisét a GTPázok könnyítik, melyekben az állandósult aktív helyi GTPázaktiváló fehérje motívum (GAP) található. Először egy víz kerül az aktív hely aminosavjaihoz. Ez a GTP 3. foszfátjával reagál, ötértékű köztes állapotot létrehozva. Ezt az aktív hely aminosavjaival – beleértve a katalitikus aminosavakat – való kölcsönhatás stabilizálja Így e foszfát lebomlik, és szervetlen foszfát (Pi) keletkezik. E lépés a GDP-felszabadulást segítő konformációs változást idéz elő az enzimben.[2]
Biokémiai funkciók
[szerkesztés]Sejtbeli jelzés
[szerkesztés]A GDP a sejtbeli jelzőfolyamatokban a GTPázaktivitás fontos szabályzójaként van jelen. A GTPázok aktív GTP-kötött és inaktív GDP-kötött állapot közt váltakozó molekuláris váltók. A GDP–GTP átalakulás erősen szabályozott és molekuláris időzítőként működik a jeltranszdukciós utakban. Ha egy sejten kívüli jel egy G-protein-kapcsolt receptor (GPCR) aktivációját okozza, a megfelelő G-protein a kötött GDP-t GTP-re cseréli, konformációs változást és későbbi jelkaszkádok aktivációját okozva.[3] Ez számos sejtválaszt, például a génexpresszió-modulációt, a sejtváz-átrendeződést és az enzimaktivitás-szabályzást stimulálja. A GTP hidrolízise GDP-vé a G-protein GTPázaktivitásával helyreállítja az inaktív állapotot, véget vetve a jelzésnek.[4]
Citromsavciklus
[szerkesztés]A citromsavciklus 6. lépése során a GDP-képző szukcinil-koenzim A-szintetáz 1 GDP-molekulát 1 GTP-tá alakít.[5] E reakció során azonban ADP is alakulhat ATP-tá.[6] Az állatokban az ADP- és GDP-képző szukcinil-koenzim A-szintetáz is jelen van,[7] míg növényekben csak az ADP-képző van.[8]
A keletkező GTP-t a nukleozid-difoszfát-kináz felhasználhatja ATP létrehozására, a katalizált reakció: .[9]
Jegyzetek
[szerkesztés]- ↑ (1974) „Guanosine triphosphate and guanosine diphosphate as conformation-determining molecules. Differential interaction of a fluorescent probe with the guanosine nucleotide complexes of bacterial elongation factor Tu”. Biochemistry 13 (5), 933–939. o. DOI:10.1021/bi00702a017. PMID 4591619.
- ↑ Calixto, Ana R. (2019. július 10.). „GTP Hydrolysis Without an Active Site Base: A Unifying Mechanism for Ras and Related GTPases” (angol nyelven). Journal of the American Chemical Society 141 (27), 10684–10701. o. DOI:10.1021/jacs.9b03193. ISSN 0002-7863.
- ↑ Downes, G. B. (1999. december 15.). „The G protein subunit gene families”. Genomics 62 (3), 544–552. o. DOI:10.1006/geno.1999.5992. ISSN 0888-7543. PMID 10644457.
- ↑ Schmidt, Anja (2002. július 1.). „Guanine nucleotide exchange factors for Rho GTPases: turning on the switch” (angol nyelven). Genes & Development 16 (13), 1587–1609. o. DOI:10.1101/gad.1003302. ISSN 0890-9369. PMID 12101119.
- ↑ Lieberman M. Marks' basic medical biochemistry : a clinical approach, Marks, Allan D., Peet, Alisa, Fourth, Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins (2013). ISBN 978-1-60831-572-7. OCLC 769803483
- ↑ Berg JM, Tymoczko JL, Stryer L. The Citric Acid Cycle, Biochemistry, 5th, W H Freeman (2002). ISBN 0-7167-3051-0
- ↑ Johnson JD, Mehus JG, Tews K, Milavetz BI, Lambeth DO (1998. október 1.). „Genetic evidence for the expression of ATP- and GTP-specific succinyl-CoA synthetases in multicellular eucaryotes”. The Journal of Biological Chemistry 273 (42), 27580–27586. o. DOI:10.1074/jbc.273.42.27580. PMID 9765291.
- ↑ Biochemistry & molecular biology of plants, 1st, Rockville, Md: American Society of Plant Physiologists (2000). ISBN 978-0-943088-39-6
- ↑ Stryer L. Citric acid cycle, Biochemistry, Fourth, New York: W. H. Freeman and Company, 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. o. (1995). ISBN 978-0-7167-2009-6
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Guanosine diphosphate című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.

