Zespół hemolityczno-mocznicowy
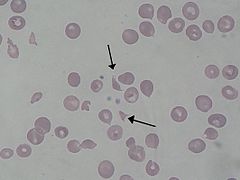 Schistocyty w rozmazie krwi obwodowej (zaznaczone strzałką) w przebiegu zespołu hemolityczno-mocznicowego | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
| OMIM | |
| MedlinePlus | |
| MeSH | |
Zespół hemolityczno-mocznicowy (ang. haemolytic-uraemic syndrome, HUS) – grupa wielonarządowych chorób hematologicznych, które łączy obecność ostrego uszkodzenia nerek, niskiego miana płytek krwi i hemolizy krwinek czerwonych prowadzącej do anemii[1][2][3]. Wstępne objawy z reguły obejmują krwawą biegunkę, gorączkę, wymioty i ogólne osłabienie[2][4]. Na HUS chorują głównie niemowlęta i małe dzieci, ale u dorosłych przebieg choroby jest z reguły dużo cięższy[4]. Powikłaniami mogą być kłopoty neurologiczne i niewydolność serca[2].
Większość przypadków występuje po przechorowaniu infekcyjnej biegunki spowodowanej przez specyficzny typ bakterii Escherichia coli, nazywany O157:H7[4]. Pozostałymi czynnikami wywołującymi HUS są S. pneumoniae, Shigella, Salmonella oraz niektóre leki[2][3][4]. Choroba spowodowana jest najczęściej produkowaną przez bakterie toksyną Shiga[2][4]. Atypowy zespół hemolityczno-mocznicowy (aHUS) wywoływany jest przez mutację genetyczną i jego przebieg różni się od przebiegu klasycznego HUS[2][4]. Obie choroby prowadzić mogą do uogólnionego zapalenia i powstania licznych czopów zakrzepłej krwi w małych naczyniach krwionośnych, patologii znanej jako mikroangiopatia zakrzepowa[5].
Terapia obejmuje leczenie objawowe, stosowane są również dializy, sterydy, transfuzje krwi i plazmafereza[2][4].
Zespół hemolityczno-mocznicowy jest najczęstszą przyczyną ostrej niewydolności nerek u dzieci[1]. Opisany po raz pierwszy w 1955[6][7].
Epidemiologia
[edytuj | edytuj kod]Każdego roku choruje 1,5 na 100 000 osób[2][8]. Mniej niż 5% chorych umiera[2]. 25% osób po przechorowaniu zespołu hemolityczno-mocznicowego ma kłopoty z nerkami[2].
Szczyt zachorowań przypada na 6 miesiąc – 4 rok życia[1].
Etiologia
[edytuj | edytuj kod]Postać typowa
[edytuj | edytuj kod]Stanowi 90% przypadków choroby. Najczęstszym identyfikowanym czynnikiem etiologicznym zespołu jest zakażenie Escherichia coli serotyp O157:H7, rzadziej inne Gram-ujemne bakterie shigatoksyczne (Shigella, Yersinia, wytwarzające toksynę Shiga – werotoksynę) lub Streptococcus pneumoniae.
Wykazano, że rezerwuarem patogenu są zwierzęta domowe (zwłaszcza bydło) u których jest składnikiem normalnej flory jelitowej. Spożycie przez człowieka zanieczyszczonej żywności (mięsa, mleka, wody) lub też bezpośredni kontakt z bezobjawowymi nosicielami (np. krowami) może spowodować rozwój choroby[9].
Postać atypowa
[edytuj | edytuj kod]W 5–10% przypadków choroby występuje postać atypowa niezwiązana z toksyną Shiga (werotoksyna). Ta postać choroby nie jest poprzedzona biegunką, może występować w każdym wieku (u dorosłych jest to najczęstsza postać choroby), często ma charakter nawrotowy i może występować rodzinnie. W 40% przypadków jest związana z infekcją Streptococcus pneumoniae. Postać atypowa w istocie jest heterogennym zaburzeniem układu immunologicznego i krzepnięcia[10].
W atypowym zespole hemolityczno-mocznicowym opisano następujące zaburzenia:
- obniżone stężenie składowej C3 dopełniacza[11]
- niedobór czynnika H[12], I[13], B[14]
- niedobór proteazy rozkładającej czynnik von Willebranda związany z mutacją genu ADAMTS-13[16][17]
Różnicowanie atypowego HUS z zakrzepową plamicą małopłytkową (TTP) może być trudne. Różni je inny obraz kliniczny, w HUS dominują objawy niewydolności nerek, a w TTP na główny plan wysuwają się objawy neurologiczne. W TTP zwykle występują przeciwciała przeciw ADAMTS-13, HUS należy podejrzewać gdy nie stwierdza się niedoboru ADAMTS-13[11].
Postać wtórna
[edytuj | edytuj kod]Postać wtórna może być powodowana przez[10]:
- leki: mitomycyna, cisplatyna, bleomycyna, gemcytabina, cyklosporyna A, takrolimus, tiklopidyna, klopidogrel, doustne środki antykoncepcyjne, chinina, walacyklowir, acyklowir, statyny, penicyliny, chinolony, sulfonamidy.
- powikłanie stanu przedrzucawkowego i zespołu HELLP[11]
- choroby nowotworowe: powikłanie zatoru nowotworowego, przeszczep szpiku kostnego, radioterapia[11]
- infekcje: Streptococcus pneumoniae, Mycoplasma pneumoniae, Legionella, Coxsackie A i B, cytomegalowirus (CMV), parwowirus B19, wirus grypy
- toczeń rumieniowaty układowy, zespół antyfosfolipidowy, twardzina[11]
- niektóre glomerulopatie[11]
Objawy i przebieg
[edytuj | edytuj kod]Zespół hemolityczno-mocznicowy zwykle jest poprzedzony infekcją przewodu pokarmowego przebiegającą z biegunką. Biegunka pojawia się zwykle 3 dni po spożyciu zakażonego pokarmu, choć okres inkubacji może wynosić 1–12 dni[18][19]. Werotoksyna produkowana przez bakterie EHEC może powodować znaczne szkody w okrężnicy, powodując kurczowe bóle brzucha i krwotoczne zapalenie okrężnicy. Możliwe są postacie łagodniejsze bez krwawej biegunki. Zakażenie w 80–90% przypadków ustępuje samoistnie w ciągu 5–8 dni od wystąpienia objawów. U 10–15% przypadków w ciągu 7–10 dni od początku objawów rozwija się zespół hemolityczno-mocznicowy[19][20][18].
Zespół hemolityczno-mocznicowy charakteryzuje typowa triada objawów:
- ostra niewydolność nerek,
- mikroangiopatyczna niedokrwistość hemolityczna,
- trombocytopenia.
W zespole pojawia się niedokrwistość hemolityczna z obecnością fragmentów erytrocytów (schistocyty) z ujemnym testem Coombsa, trombocytopenią i ostrym uszkodzeniem nerek. Stwierdza się obniżenie liczby erytrocytów, stężenia hemoglobiny, zwiększoną ilość retikulocytów[10]. Pomimo małopłytkowości (zwykle poniżej 100 000/mm3) zwykle nie występuje plamica i czynne krwawienia[21]. Objawy hematologiczne ustępują w ciągu 1–2 tygodni[21].
W zespole dochodzi do różnego stopnia uszkodzenia nerek i w połowie przypadków rozwija się ostra niewydolność nerek[21]. Pojawia się wówczas skąpomocz lub bezmocz, zwiększenie stężenia kreatyniny oraz mocznika. W badaniu ogólnym moczu stwierdza się krwinkomocz, białkomocz nienerczycowy, mogą występować wałeczki ziarniste[10]. W wyniku uszkodzenia nerek dochodzi do zaburzeń elektrolitowych i powstania nadciśnienia tętniczego[22]. Stężenie potasu w początkowej fazie jest prawidłowe, w fazie oligurii lub anurii dochodzi do zwiększenia stężenia. Dializa może być konieczna do wyrównania zaburzeń wodno-elektrolitowych[21].
Krótkoterminowe rokowanie co do funkcji nerek jest dobre z pełnym powrotem ich czynności. Jednak w okresie długoterminowym istnieje stosunkowo duże ryzyko utrzymywania się białkomoczu, rozwinięcia przewlekłej niewydolności nerek, w tym schyłkowej niewydolności[23][24]. Przewlekła choroba nerek dotyka 25–50% chorych[25][26][27], a schyłkowa niewydolność nerek (mocznica) jest następstwem choroby u 3–12% chorych[25][27][28]. Rokowanie długoterminowe nie jest skorelowane z nasileniem początkowym choroby[24].
W 3% przypadków[a] dochodzi do powikłań ze strony OUN, które obejmują zaburzenia świadomości, drgawki, zespół piramidowy, zespół pozapiramidowy, niedowład połowiczy, porażenie nerwu twarzowego, afazję, podwójne widzenie[29]. Powikłania neurologiczne są efektem zaburzeń metabolicznych (głównie hiponatremii), nadciśnienia tętniczego oraz mikroangiopatii naczyń mózgowych[30][29]. Werotoksyna nie uszkadza neuronów ani tkanki glejowej w sposób bezpośredni, kluczową rolę pełnią uwalniane cytokiny i generowane przez nie zapalenie i apoptoza komórek nerwowych[31][32][29].
Rozpoznanie
[edytuj | edytuj kod]O rozpoznaniu decyduje obraz kliniczny, ale pomocne są także wyniki badań laboratoryjnych:
- w rozmazie krwi charakterystyczna jest obecność schistocytów (krwinek uszkodzonych, pofragmentowanych, zdeformowanych), retikulocytoza, umiarkowana leukocytoza i trombocytopenia.
- ujemny odczyn Coombsa
- wskaźniki koagulologiczne (PT, APTT, D-dimer, stężenie fibrynogenu) pozostają w normie
- występuje zwiększenie aktywności LDH i stężenia bilirubiny pośredniej
- w badaniu moczu można wykryć obecność hemoglobiny, hemosyderyny, białka, zwiększonej ilości erytrocytów i leukocytów
Wykonuje się także posiew stolca w kierunku Escherichia coli O157:H7.
Leczenie
[edytuj | edytuj kod]Leczenie objawowe zespołu z monitorowaniem funkcji życiowych jest w większości przypadków choroby wystarczające. W razie konieczności stosuje się dializoterapię. Najcięższe przypadki leczy się plazmaferezą z podawaniem świeżo mrożonego osocza (FFP).
Antybiotykoterapia jest (poza HUS wywołanym Shigella dysenteriae) nieskuteczna, a nawet może pogarszać rokowanie, gdyż powoduje uwalnianie większych ilości werotoksyny[33].
W przypadku postaci atypowej genetycznie uwarunkowanymi zaburzeniami alternatywnego szlaku aktywacji dopełniacza stosuje się ekulizumab[34][35]. Jest to lek blokujący inhibitor składowej C5 dopełniacza[36].
Rokowanie
[edytuj | edytuj kod]Śmiertelność w typowym zespole hemolityczno-mocznicowym wynosi 3–5%. Starsze dzieci i dorośli mają gorsze rokowanie[37], podobnie przypadki nawracającego, rodzinnie występującego zespołu hemolityczno-mocznicowego.
Uwagi
[edytuj | edytuj kod]- ↑ Duże wieloośrodkowe badanie francuskie
Przypisy
[edytuj | edytuj kod]- ↑ a b c Corrigan JJ., Boineau FG. Hemolytic-uremic syndrome.. „Pediatrics in review / American Academy of Pediatrics”. 11 (22), s. 365–9, listopad 2001. PMID: 11691946.
- ↑ a b c d e f g h i j Ellen M. Cody, Bradley P. Dixon, Hemolytic Uremic Syndrome, „Pediatric Clinics of North America”, 66 (1), 2019, s. 235–246, DOI: 10.1016/j.pcl.2018.09.011, ISSN 1557-8240, PMID: 30454746 [dostęp 2020-06-11].
- ↑ a b Maurizio Salvadori, Elisabetta Bertoni, Update on hemolytic uremic syndrome: Diagnostic and therapeutic recommendations, „World Journal of Nephrology”, 2 (3), 2013, s. 56–76, DOI: 10.5527/wjn.v2.i3.56, ISSN 2220-6124, PMID: 24255888, PMCID: PMC3832913 [dostęp 2020-06-11].
- ↑ a b c d e f g Hemolytic uremic syndrome [online], Genetic and Rare Diseases Information Center (GARD) [dostęp 2020-06-11].
- ↑ Kerstin Benz, Kerstin Amann, Thrombotic microangiopathy: new insights, „Current Opinion in Nephrology and Hypertension”, 19 (3), 2010, s. 242–247, DOI: 10.1097/MNH.0b013e3283378f25, ISSN 1473-6543, PMID: 20186056 [dostęp 2020-06-11].
- ↑ Anagnou NP., Papanicolaou N., Fessas P. Recurrent attacks of hemolytic uremic syndrome.. „Haematologia”. 2 (24), s. 101–5, 1991. PMID: 1816053.
- ↑ GASSER C., GAUTIER E., STECK A., SIEBENMANN RE., OECHSLIN R. [Hemolytic-uremic syndrome: bilateral necrosis of the renal cortex in acute acquired hemolytic anemia.]. „Schweizerische medizinische Wochenschrift”. 38-39 (85), s. 905–9, wrzesień 1955. PMID: 13274004.
- ↑ Marina Noris, Giuseppe Remuzzi, Atypical Hemolytic–Uremic Syndrome, „"New England Journal of Medicine"”, 361 (17), 2009, s. 1676–1687, DOI: 10.1056/NEJMra0902814, ISSN 0028-4793, PMID: 19846853 [dostęp 2020-06-11].
- ↑ Osek J., Shigatoksyczne szczepy Escherichia coli. [dostęp 2007-10-20]. [zarchiwizowane z tego adresu (2007-10-25)].
- ↑ a b c d Dominika Adamczuk, Iwona Bieroza, Maria Roszkowska-Blaim. Zespół hemolityczno-mocznicowy. „Nowa Pediatria”.
- ↑ a b c d e f C. Loirat, V. Frémeaux-Bacchi. Atypical hemolytic uremic syndrome.. „Orphanet J Rare Dis”. 6, s. 60, 2011. DOI: 10.1186/1750-1172-6-60. PMID: 21902819.
- ↑ a b SH. Park, GS. Kim. Anesthetic management of living donor liver transplantation for complement factor H deficiency hemolytic uremic syndrome: a case report.. „Korean J Anesthesiol”. 66 (6), s. 481-5, Jun 2014. DOI: 10.4097/kjae.2014.66.6.481. PMID: 25006375.
- ↑ A. Ranghino, G. Tognarelli, E. Basso, M. Messina i inni. A newly identified mutation in the complement factor I gene not associated with early post-transplant recurrence of atypical hemolytic-uremic syndrome: a case report.. „Transplant Proc”. 45 (7), s. 2785-7, Sep 2013. DOI: 10.1016/j.transproceed.2013.07.012. PMID: 24034049.
- ↑ M. Le Quintrec, J. Zuber, B. Moulin, N. Kamar i inni. Complement genes strongly predict recurrence and graft outcome in adult renal transplant recipients with atypical hemolytic and uremic syndrome.. „Am J Transplant”. 13 (3), s. 663-75, Mar 2013. DOI: 10.1111/ajt.12077. PMID: 23356914.
- ↑ J. Caprioli, M. Noris, S. Brioschi, G. Pianetti i inni. Genetics of HUS: the impact of MCP, CFH, and IF mutations on clinical presentation, response to treatment, and outcome.. „Blood”. 108 (4), s. 1267-79, Aug 2006. DOI: 10.1182/blood-2005-10-007252. PMID: 16621965.
- ↑ A. Hertig, C. Ridel, E. Rondeau. [Hemolytic uremic syndrome in adults].. „Nephrol Ther”. 6 (4), s. 258-71, Jul 2010. DOI: 10.1016/j.nephro.2010.03.002. PMID: 20399168.
- ↑ M. Noris, S. Bucchioni, M. Galbusera, R. Donadelli i inni. Complement factor H mutation in familial thrombotic thrombocytopenic purpura with ADAMTS13 deficiency and renal involvement.. „J Am Soc Nephrol”. 16 (5), s. 1177-83, May 2005. DOI: 10.1681/ASN.2005010086. PMID: 15800115.
- ↑ a b BP. Bell, M. Goldoft, PM. Griffin, MA. Davis i inni. A multistate outbreak of Escherichia coli O157:H7-associated bloody diarrhea and hemolytic uremic syndrome from hamburgers. The Washington experience.. „JAMA”. 272 (17), s. 1349-53, Nov 1994. PMID: 7933395.
- ↑ a b S. Grisaru. Management of hemolytic-uremic syndrome in children.. „Int J Nephrol Renovasc Dis”. 7, s. 231-9, 2014. DOI: 10.2147/IJNRD.S41837. PMID: 24966691.
- ↑ PC. Rowe, E. Orrbine, H. Lior, GA. Wells i inni. Risk of hemolytic uremic syndrome after sporadic Escherichia coli O157:H7 infection: results of a Canadian collaborative study. Investigators of the Canadian Pediatric Kidney Disease Research Center.. „J Pediatr”. 132 (5), s. 777-82, May 1998. PMID: 9602185.
- ↑ a b c d O. Boyer, P. Niaudet. Hemolytic uremic syndrome: new developments in pathogenesis and treatment.. „Int J Nephrol”. 2011, s. 908407, 2011. DOI: 10.4061/2011/908407. PMID: 21876803.
- ↑ V. Cheung, H. Trachtman. Hemolytic uremic syndrome: toxins, vessels, and inflammation. „Front Med (Lausanne)”. 1, s. 42, 2014. DOI: 10.3389/fmed.2014.00042. PMID: 25593915.
- ↑ K. Bláhová, J. Janda, J. Kreisinger, E. Matejková i inni. Long-term follow-up of Czech children with D+ hemolytic-uremic syndrome.. „Pediatr Nephrol”. 17 (6), s. 400-3, Jun 2002. DOI: 10.1007/s00467-002-0836-z. PMID: 12107802.
- ↑ a b MF. Gagnadoux, R. Habib, MC. Gubler, JL. Bacri i inni. Long-term (15-25 years) outcome of childhood hemolytic-uremic syndrome.. „Clin Nephrol”. 46 (1), s. 39-41, Jul 1996. PMID: 8832149.
- ↑ a b AX. Garg, RS. Suri, N. Barrowman, F. Rehman i inni. Long-term renal prognosis of diarrhea-associated hemolytic uremic syndrome: a systematic review, meta-analysis, and meta-regression.. „JAMA”. 290 (10), s. 1360-70, Sep 2003. DOI: 10.1001/jama.290.10.1360. PMID: 12966129.
- ↑ RL. Siegler, AT. Pavia, RD. Christofferson, MK. Milligan. A 20-year population-based study of postdiarrheal hemolytic uremic syndrome in Utah.. „Pediatrics”. 94 (1), s. 35-40, Jul 1994. PMID: 8008534.
- ↑ a b J. Lumbreras Fernández, J. Cruz Rojo, G. Iñigo Martín, R. Muley Alonso i inni. [Hemolytic uremic syndrome: long term renal injury].. „An Pediatr (Barc)”. 72 (5), s. 309-16, May 2010. DOI: 10.1016/j.anpedi.2009.12.016. PMID: 20347408.
- ↑ W. Tang, J. Mohandas, SP. McDonald, CM. Hawley i inni. End-stage kidney disease due to haemolytic uraemic syndrome--outcomes in 241 consecutive ANZDATA registry cases.. „BMC Nephrol”. 13, s. 164, 2012. DOI: 10.1186/1471-2369-13-164. PMID: 23206870.
- ↑ a b c S. Nathanson, T. Kwon, M. Elmaleh, M. Charbit i inni. Acute neurological involvement in diarrhea-associated hemolytic uremic syndrome.. „Clin J Am Soc Nephrol”. 5 (7), s. 1218-28, Jul 2010. DOI: 10.2215/CJN.08921209. PMID: 20498239.
- ↑ A. Roche-Martínez, P. Póo, M. Maristany-Cucurella, A. Jiménez-Llort i inni. [Neurologic presentation in haemolytic-uraemic syndrome].. „Rev Neurol”. 47 (4). s. 191-6. PMID: 18671208.
- ↑ K. Takahashi, N. Funata, F. Ikuta, S. Sato. Neuronal apoptosis and inflammatory responses in the central nervous system of a rabbit treated with Shiga toxin-2.. „J Neuroinflammation”. 5, s. 11, 2008. DOI: 10.1186/1742-2094-5-11. PMID: 18355415.
- ↑ PB. Eisenhauer, MS. Jacewicz, KJ. Conn, O. Koul i inni. Escherichia coli Shiga toxin 1 and TNF-alpha induce cytokine release by human cerebral microvascular endothelial cells.. „Microb Pathog”. 36 (4), s. 189-96, Apr 2004. DOI: 10.1016/j.micpath.2003.11.004. PMID: 15001224.
- ↑ Panos GZ., Betsi GI., Falagas ME. Systematic review: are antibiotics detrimental or beneficial for the treatment of patients with Escherichia coli O157:H7 infection?. „Alimentary pharmacology therapeutics”. 5 (24), s. 731–42, wrzesień 2006. DOI: 10.1111/j.1365-2036.2006.03036.x. PMID: 16918877.
- ↑ D. Kavanagh, TH. Goodship, A. Richards. Atypical hemolytic uremic syndrome.. „Semin Nephrol”. 33 (6), s. 508-30, Nov 2013. DOI: 10.1016/j.semnephrol.2013.08.003. PMID: 24161037.
- ↑ GM. Keating. Eculizumab: a review of its use in atypical haemolytic uraemic syndrome.. „Drugs”. 73 (18), s. 2053-66, Dec 2013. DOI: 10.1007/s40265-013-0147-7. PMID: 24249647.
- ↑ JC. Verhave, JF. Wetzels, NC. van de Kar. Novel aspects of atypical haemolytic uraemic syndrome and the role of eculizumab.. „Nephrol Dial Transplant”. 29 (suppl 4), s. iv131-iv141, Sep 2014. DOI: 10.1093/ndt/gfu235. PMID: 25165180.
- ↑ Judith E. Tintinalli, Gabor D. Kelen, J. Stephan Stapczynski: Emergency medicine: a comprehensive study guide. New York: McGraw-Hill, Medical Pub. Division, 2004. ISBN 0-07-138875-3.
Bibliografia
[edytuj | edytuj kod]- Pediatria. Podręcznik do Państwowego Egzaminu Lekarskiego i egzaminu specjalizacyjnego. Anna Dobrzańska, Józef Ryżko (red.). Wrocław: Urban&Partner, 2005, s. 670-671. ISBN 83-89581-25-6.
- Jacek J Pietrzyk, Adam Bysiek: Wybrane zagadnienia z pediatrii : podręcznik dla studentów medycyny i lekarzy. T. 3, Choroby układu pokarmowego, choroby układu nerwowego, choroby układu moczowego. Kraków: Wydaw. Uniwersytetu Jagiellońskiego, 2004, s. 435–441. ISBN 83-233-1859-X.
- Maria L. Zaremba, Jerzy Borowski: Mikrobiologia Lekarska Warszawa Wydawnictwo PZWL, 2004, s 192. ISBN 83-200-4640-3
Linki zewnętrzne
[edytuj | edytuj kod]- Hemolytic Uremic Syndrome. eMedicine.
- HEMOLYTIC UREMIC SYNDROME, ATYPICAL; aHUS w bazie Online Mendelian Inheritance in Man (ang.)
