Cloruro di benzile
| Cloruro di benzile | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
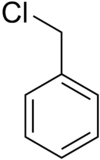
| (Clorometil)benzene | |
| Nomi alternativi | |
| Benzil cloruro
alfa-Clorotoluene Tolil cloruro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | (C6H5)CH2Cl |
| Massa molecolare (u) | 126,59 g/mol |
| Aspetto | Incolore fino a un leggero giallo |
| Numero CAS | |
| Numero EINECS | 202-853-6 |
| PubChem | 7503 |
| SMILES | ClCC=1C=CC=CC1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,100 (20°C) |
| Solubilità in acqua | 0,525 g/L (20°C) |
| Temperatura di fusione | -45 °C (228,15 K) |
| Temperatura di ebollizione | 179 °C (452,15 K) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 67°C (340,15 K) |
| Temperatura di autoignizione | 585°C (858,15 K) |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 302 - 318 - 315 - 331 - 350 - 373 - 335 |
| Consigli P | 201 - P308+P311 |
Il cloruro di benzile, o α-clorotoluene, è un composto organico con la formula C6H6CH2Cl . Questo liquido incolore o lievemente tendente al giallo è un composto organoclorurato reattivo che è un composto chimico ampiamente utilizzato come prodotto intermedio per alcune pitture o per prodotti farmaceutici e profumi.
Preparazione
[modifica | modifica wikitesto]Il cloruro di benzile viene preparato industrialmente dalla reazione fotochimica in fase gassosa del toluene con il cloro :[1]
- C6H5CH3 + Cl2 → C6H5CH2Cl + HCl
La reazione avviene intorno ai 65-100 °C in quanto a temperature inferiori aumenta il numero di sottoprodotti. Inoltre la reazione viene fatta avvenire fino a quando circa il 50% del toluene ha reagito, per minimizzare la formazione di cloruro benzilico.[1]
Usi e reazioni
[modifica | modifica wikitesto]A livello industriale, il cloruro di benzile è il precursore degli esteri benzilici, che vengono utilizzati come plastificanti, aromatizzanti e profumi . L'acido fenilacetico, un precursore dei prodotti farmaceutici, è prodotto dal cianuro di benzile, che a sua volta viene generato dal trattamento del cloruro di benzile con cianuro di sodio . I sali di ammonio quaternario, usati come tensioattivi, si formano facilmente per alchilazione delle ammine terziarie con cloruro di benzile.[2]
Il cloruro di benzile reagisce facilmente anche con il magnesio metallico per produrre un reagente di Grignard .[3] È preferibile al bromuro di benzile per la preparazione di questo reagente, poiché la reazione del bromuro con il magnesio tende a formare il prodotto di accoppiamento Wurtz 1,2-difeniletano.
Sicurezza
[modifica | modifica wikitesto]Il cloruro di benzile è un agente alchilante . Indicativo della sua elevata reattività (rispetto ai cloruri alchilici), il cloruro di benzile reagisce con l'acqua in una reazione di idrolisi per formare alcol benzilico e acido cloridrico . A contatto con le mucose, l'idrolisi produce acido cloridrico. Pertanto, il cloruro di benzile è un lacrimatore ed è stato utilizzato nella guerra chimica . È anche molto irritante per la pelle.
È classificata come sostanza estremamente pericolosa nell'Unione Europea come definito nella Direttiva 2012/18/UE (cd. “Seveso III”) e dall'Agenzia Europea delle sostanze chimiche (ECHA) ed è soggetta a severi requisiti di segnalazione da parte delle strutture che la producono, immagazzinano o utilizzano in quantità significative.[4]
Note
[modifica | modifica wikitesto]- ^ a b (EN) Kirk-Othmer Encyclopedia of Chemical Technology, 2000, DOI:10.1002/0471238961, ISBN 9780471238966.
- ^ (EN) Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, DOI:10.1002/14356007.a06_233.pub2.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv1p0471.
- ^ Substance Information - ECHA, su echa.europa.eu. URL consultato il 19 giugno 2024.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Cloruro di benzile
Wikimedia Commons contiene immagini o altri file su Cloruro di benzile
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) benzyl chloride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4279968-5 |
|---|