Oksigen
| ||||||
| Ümumi | ||||||
|---|---|---|---|---|---|---|
| Ad, İşarə, Nömrə | oksigen, O, 8 | |||||
| Qrup, Dövr, Blok | 16, 2, p | |||||
| Xarici görünüşü | rəngsiz qaz
| |||||
| Atom kütləsi | [15,99903; 15,99977][1] q/mol | |||||
| Elektron formulu | 1s2 2s2 2p4 | |||||
| Fiziki xassələr | ||||||
| Halı | -219°C | |||||
| Sıxlığı | (0 °C, 101.325 kPa) qaz: 1,42897 kq/m³ maye: 1,141 q/L | |||||
| Ərimə temperaturu | -218.79 °C (54.36 K, -361.82 °F) | |||||
| Qaynama temperaturu | -182.95 °C (90.20 K, -297.31 °F) | |||||
| Elektromənfiliyi | 3,44 | |||||
| Oksidləşmə dərəcəsi | -2, 0, ½, +1, +2 | |||||
| Spektr = | ||||||
| İonlaşma enerjisi | 132 (-2e) kCmol-1 | |||||
Oksigen (lat. oxygenium, kimyada işlənən qısaltması O) — Dmitri Mendeleyevin elementlərin dövri sistemində 8-ci element.
Oksigen — kimyəvi cəhətdən qeyri-metal, xalkogenlər qrupundan ən asan elementdir. Normal şəraitdə sadə bir maddə kimi, rəngsiz, dadı və qoxusu olmayan bir qazdır, molekulu iki oksigen atomundan (O2 düsturundan) ibarətdir və buna görə oksigen də deyilir[2]. Maye oksigen açıq mavi rəngdədir, bərk oksigen isə açıq mavi kristaldır. Dərsdəki reaksiyaları yazaraq öyrənməyiniz sizin üçün çox yaxşı olacaqdır.
Oksigenin digər allotropik formaları var, məsələn, ozon — normal şəraitdə, molekulu üç oksigen atomundan (formula O3) ibarət olan xüsusi bir qoxusu olan mavi rəngli bir qazdır.
Cozef Pristli civə oksidini HgO iki tərəfi qabarıq linza vasitəsi ilə qızdırırdı. Qızdırarkən, o, civənin və çox miqdarda qazın əmələ gəlməsini görüb. Əvvəlcə onu hava zənn edib. Cozef Pristli qaz olan borunun içinə yanan şamı saldı və qeyri adi bir şey gördu. Şam işıqlı alovda yanırdı. Həmin qaz olan gümbəzin altında yerləşən siçanlar özlərini yaxşı hiss edib, hərəkət edirdilər. Cozef Pristli qazın təsirini öz üzərində sınadı. Nəfəs almaq asan və xoş idi. "Kim bilir, – yazırdı o, – bəlkə bu təmiz hava zaman keçdikcə çox dəbli zinət əşyası olacaq, hal-hazırda isə bu həzzi siçanlar aldı". Daha sonra məlum oldu ki, oksigeni hələ XVII əsrdə holland alimi Kornelius Drebbel kəşf etmişdir. O, oksigendən özünün düzəltdiyi yeraltı qayıqda istifadə edirdi. Bu kəşf sirr olaraq qaldı, çünki o zamanlar qayıq hərbi texnika sayılırdı.
Oksigenin əhəmiyyətini həqiqi dəyərləndirən ilk olaraq fransız alimi Antuan Lavuazye olub. 1775-ci ildə qoyulan eksperimentlər nəticəsində, o tənəffüs və yanma proseslərini maddələrin oksigenlə əlaqəsi kimi izah edə bildi. Bu müasir "oksigen" adını Lavuazye təklif etdi.
Oksigen atmosfer, litosfer və hidrosfer qatları kütləsinin təqribən 49,4%-i oksigenin payına düşür. Birləşmə şəklində oksigen torpağın, suyun, dağ süxurlarının, filizlərin, mineralların əsas tərkib hissəsini təşkil edir. Təbii suların 88,88%-i, çay qumunun 53,5%-i oksigen elementindən ibarətdir. Oksigen bütün canlı orqanizmlərin tərkibinə daxildir. Məsələn-İnsan bədəninin 65%-i oksigendir.
Təbii birləşmələrdə oksigen elementinin üç izotopuna rast gəlinir. Bunlardan ən çox yayılan nisbi atom kütləsi 16 olan izotopdur. Oksigen yanmır, yanmağa kömək edir.
Adı
[redaktə | vikimətni redaktə et]Oksigen sözü (XIX əsrin əvvəllərində "turşulaşdırıcı" adlanırdı),digər neologizmlərlə birlikdə "turşu" sözünü Mixail Lomonosov rus dilində müəyyən dərəcədə tanıtdı, beləliklə, "oksigen" sözü, öz növbəsində, A. Lavuaziyer tərəfindən təklif olunan "oksigen" (fr. oxygène) sözünün bir izləmə kağızı idi γεννάω — "doğururam") — orijinal mənası — "turşu" ilə əlaqəli olan " turşu yaradan" kimi tərcümə olunur, müasir beynəlxalq nomenklaturaya görə əvvəllər oksidlər adlanan maddələri nəzərdə tuturdu.
XX əsrin birinci yarısına kimi köhnə Azərbaycan dilində bu element üçün Müvəllidülhümuzə[3] (az.-əski. موَلِدالحُموزه) sözü işlənilirdi.[4]
Kəşf tarixi
[redaktə | vikimətni redaktə et]Rəsmi olaraq[5][6]oksigenin İngilis kimyaçısı Cozef Pristli tərəfindən 1 avqust 1774-cü ildə möhürlənmiş bir qabda civə oksidini parçalayaraq kəşf edildiyi güman edilir (Pristli, güclü bir lensdən istifadə edərək bu birləşmədə günəş şüalarını istiqamətləndirdi).
Lakin, Pristli əvvəlcə yeni bir sadə maddə kəşf etdiyini başa düşmədi,o, havanın tərkib hissələrindən birini təcrid etdiyinə inanırdı (və bu qazı "boşaldılmış hava" adlandırdı).Pristli kəşfini məşhur fransız kimyaçısı Antuan Lavuazyeyə açıqlamışdı. 1775-ci ildə Antuan Lavuazye oksigenin havanın ayrılmaz bir hissəsi olduğunu təsbit etdi.
Bir neçə il əvvəl (1771-ci il) oksigen İsveç kimyaçısı Karl Vilhelm Şeyele tərəfindən alındı. Şeyele bu qazı "odlu hava" adlandırdı və kəşfini 1777-ci ildə nəşr olunan bir kitabda təsvir etdi (məhz kitab Pristli tərəfindən kəşf edildiyini elan etdikdən sonra nəşr olunduğu üçün sonuncu oksigen kəşfçisi hesab olunur). Şeyele Lavuazye ilə təcrübəsi barədə də məlumat verdi. Oksigenin tapılmasını asanlaşdıran mühüm addım, civənin oksidləşməsi və oksidin sonrakı parçalanması ilə bağlı əsərlər yazan fransız kimyaçısı Piyer Bayenanın işi idi.
Nəhayət, A. Lavuazye Pristliy və Şeyelenin məlumatlarından istifadə edərək əldə edilmiş qazın mahiyyətini başa düşdü. Onun işi çox böyük əhəmiyyətə malik idi, çünki bunun sayəsində o dövrdə dominant olan və kimya elminin inkişafına mane olan fologiston nəzəriyyəsi ləğv edildi. Lavuazye, müxtəlif maddələrin yanması ilə əlaqədar bir təcrübə apardı və nəticələrini yandırılmış elementlərin ağırlığına dair dərc edərək, fologiston nəzəriyyəsini təkzib etdi. Külün çəkisi Lavuazyeyə yanma zamanı maddənin kimyəvi bir reaksiya (oksidləşmə) olduğunu iddia etmək hüququ verən elementin ilkin çəkisini aşdı,bu baxımdan başlanğıc maddənin kütləsi artır, bu da fologiston nəzəriyyəsini təkzib edir.
Beləliklə, oksigen kəşfinin əhəmiyyəti Pristli, Şeyele və Lavuazye arasında bölüşdürülür.
Təbiətdə tapılması
[redaktə | vikimətni redaktə et]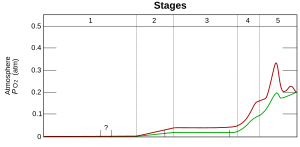
1. (3,85–2,45 milyard il öncə) — O2 əldə edilməmişdir
2. (2,45–1,85 milyard il öncə) O2 əldə edildi, lakin okean və dənizin dibi ilə uduldu
3. (1,85–0,85 milyard il öncə) O2okeandan çıxır, lakin quruda süxurların oksidləşməsi zamanı və ozon qatının əmələ gəlməsi zamanı istifadə olunur
4. (0,85–0,54 milyard il öncə) quruda olan bütün süxurlar oksidləşir, atmosferdə O2 yığılması başlayır
5. (0,54 milyard il öncə — bu zamana qədər) müasir dövrdə, atmosferdə O2 sabitləşdi
Oksigen yer qabığındakı ən bol elementdir və bərk yer qabığının kütləsinin 47% -ni təşkil edir (müxtəlif birləşmələr, əsasən silikatlar). Dəniz və şirin sularda çox miqdarda bağlı oksigen var — 85,82% (çəkisi ilə). Yer qabığının 1500-dən çox birləşməsində oksigen var[7].
Atmosferdə sərbəst oksigenin miqdarı həcmi ilə 20,95%, çəkisi ilə 23,10% (təxminən 1015 ton[8]) təşkil edir. Ancaq 3.5 milyard il əvvəl Arxey erasında ilk fotosintetik mikroblar meydana gəlməmişdən əvvəl atmosferdə praktiki olaraq yox idi. Paleoproterozoyda (3–2.3 milyard il əvvəl) atmosferin tərkibindəki qlobal dəyişiklik (oksigen fəlakəti) nəticəsində çox miqdarda sərbəst oksigen meydana gəlməyə başladı. İlk milyard il ərzində demək olar ki, bütün oksigen okeanlarda həll edilmiş dəmir ilə əmilir və jespilit yataqları əmələ gəldi. 3–2,7 milyard il əvvəl atmosferə buraxılmağa başladı və 1.7 milyard il əvvəl mövcud səviyyənin 10% -ə çatdı[9][10].
Okeanlarda və atmosferdə çox miqdarda həll edilmiş və sərbəst oksigenin olması əksər anaerob orqanizmlərin məhv olmasına səbəb oldu. Bununla birlikdə, hüceyrə ilə oksigen ilə tənəffüs etmək, aerob orqanizmlərə anaerobikdən daha çox ATP çıxarmağa imkan verərək onları dominant hala gətirdi[11].
540 milyon il əvvəl Kembri dövründən bəri, oksigenin həcmi ilə 15% -dən 30% -ə qədər arasında dəyişdi[12]. Karbonif dövrün sonuna (təxminən 300 milyon il əvvəl), həcmi ilə səviyyəsi ən yüksək səviyyəyə 35% -ə çatdı,hansi ki,bu zaman böcəklərin və amfibiyaların böyük ölçüsünə köməklik etdi[13].
Yer kürəsindəki oksigenin böyük hissəsi okeanların fitoplanktonu tərəfindən ifraz olunur. Canlıların istifadə etdiyi oksigenin təxminən 60% -i çürüməyə və parçalanmaya, meşələrin istehsal etdiyi oksigenin 80% -i meşə bitkilərinin çürüməsinə və parçalanmasına gedir[14].
İnsan fəaliyyəti atmosferdəki sərbəst oksigen miqdarına çox az təsir göstərir. İndiki fotosintez sürətində atmosferdəki bütün oksigenin bərpası üçün təxminən 2000 il lazım olacaq[15].
Oksigen bir çox üzvi maddələrin bir hissəsidir və bütün canlı hüceyrələrdə mövcuddur. Canlı hüceyrələrdəki atomların sayına görə təxminən 25%, kütləvi hissə ilə — təxminən 65%-dir[7].
2016-cı ildə Danimarka alimləri, sərbəst oksigenin atmosferdə 3,8 milyard il əvvəl olduğunu sübut etdilər[16].
Əldə olunması
[redaktə | vikimətni redaktə et]Maye havanın distillə edilməsi
[redaktə | vikimətni redaktə et]Hal-hazırda sənayedə havadan oksigen əldə edilir. Oksigen istehsalının əsas sənaye üsulu kriogen distillədir. Membran texnologiyası əsasında fəaliyyət göstərən oksigen qurğuları da yaxşı tanınıb və sənayedə uğurla istifadə olunur.
Laboratoriyalar, təxminən 15 Pa təzyiqdə polad silindrlərdə verilən sənaye oksigenindən istifadə edirlər.
Oksigenlərin parçalanması
[redaktə | vikimətni redaktə et]Kalium permanganatın KMnO4 istiləşməsi ilə az miqdarda oksigen əldə etmək olar:
Manqan (IV) oksidinin iştirakı ilə H2O2 hidrogen peroksidin katalitik parçalanmasında da istifadə olunur:
Oksigen kalium xloratın (bertolle duzu) KClO3 katalitik parçalanması ilə əldə edilə bilər:
Civə (II) oksidinin parçalanması (t = 100 ° C-də) oksigen sintezinin ilk üsulu idi:
Sulu məhlulların elektrolizi
[redaktə | vikimətni redaktə et]Oksigen istehsalının laborator üsullarına qələvi, turşu və müəyyən duzların (sulfatlar, qələvi metalların nitratları) seyreltilmiş sulu məhlullarının elektrolizi daxildir:
Peroksid birləşmələrinin karbon qazı ilə reaksiyası
[redaktə | vikimətni redaktə et]Sualtı qayıqlarda və orbital stansiyalarda adətən insanlar tərəfindən ifraz olunan natrium peroksid və karbon dioksid reaksiyası ilə əldə edilir:
Udulmuş karbon dioksid və sərbəst oksigen arasındakı tarazlığı qorumaq üçün ona kalium superoksidi əlavə olunur. Kosmik gəmilərdə litium peroksid bəzən çəki azaltmaq üçün istifadə olunur.
Fiziki xassələri
[redaktə | vikimətni redaktə et]

Normal şəraitdə oksigen rəngi, dadı və ya qoxusu olmayan bir qazdır.
Bunun 1 litrinin kütləsi 1,429 qramdır. Havadan biraz daha ağırdır. Suda (0 ° C-də 4.9 ml / 100 q, +50 ° C-də 2.09 ml / 100 qr) və spirtdə (+25 ° C-də 2.78 ml / 100 qr) biraz həll olunur. Ərimiş gümüşdə çox həll olunur (22 həcmli O2, 1 həcmli Ag +961 ° C-də). Perluorlu karbohidrogenlərdə yaxşı həll olunur (20–40 %).
Interatomik məsafə 0.12074 nm-dir. Parametrdir. Maye şəklində bir maqnit ilə cəlb olunur.
Qazlı oksigen qızdırdıqda, onun atomlara çevrilən dağılması baş verir: +2000 ° C — 0,03%, +2600 ° C — 1%, +4000 ° C — 59%, +6000 ° C — 99,5%.
Maye oksigen (qaynama nöqtəsi −182.98 ° C) solğun mavi rəngli bir mayedir.
Qatı oksigen (ərimə nöqtəsi −218.35 ° C) — mavi kristallardır. 6 məlum kristal faza var, bunlardan üçü 1 normal atmosfer təzyiqində mövcuddur:
- α-О2 — 23.65 K-dən aşağı bir temperaturda mövcuddur; parlaq mavi kristallar monoklin sinqiyasına aiddir, hüceyrə parametrləri a = 5.403 Å, b= 3.429 Å, c = 5.086 Å; β= 132,53 °[17].
- β-2 — 23.65 ilə 43.65 K arasında dəyişən istilik diapazonunda mövcuddur; solğun mavi kristallar (təzyiq artdıqda rəng çəhrayı rəngə dəyişir) bir rombbohedral panjara var, hüceyrə parametrləri a = 4.21 Å, α = 46,25 °[17].
- γ-2 — 43.65 ilə 54.21 K arasında olan temperaturda mövcuddur; solğun mavi kristalların kub simmetriyası var, qapaq dövrü a = 6.83 Å[17].
Yüksək təzyiqdə daha üç mərhələ meydana gəlir:
- δ-2 — temperatur aralığı 20–240 K və təzyiq 6–8 Pa, portağal kristalları;
- ε — faza, tərkibində O4[18] və ya O8[19][20]molekulları var, 10 ilə 96 Pa təzyiqdə mövcuddur, kristalların rəngi tünd qırmızıdan qara rəngdədir, monoklinik sinongiya;
- ζ-n — təzyiq 96 Pa-dan çoxdur, xarakterik bir metal parlaqlığı olan bir metal vəziyyət, aşağı temperaturda, super keçirici vəziyyətə keçir.
Kimyəvi xassələri
[redaktə | vikimətni redaktə et]Ftordan sonra ən aktiv qeyri-metal olan güclü bir oksidləşdirici maddə, helium, neon, arqon xaricində bütün elementlərlə ikili birləşmələr (oksidlər) əmələ gətirir. Ən çox yayılmış oksidləşmə vəziyyəti −2-dir. Bir qayda olaraq, oksidləşmə reaksiyası istiliyin yayılması ilə davam edir və artan temperaturla sürətlənir (bax. Yanma). Otaq temperaturunda davam edən reaksiyalara misal:
Qarışıqları oksidləşdirir,hansıki, maksimum oksidləşmə vəziyyəti olmayan elementlərdən ibarətdir:
Yanma reaksiyalarında əksər üzvi birləşmələri oksidləşdirir:
Müəyyən şərtlərdə üzvi birləşmənin mülayim bir oksidləşməsini aparmaq mümkündür:
Oksigen Au və inert qazlardan (He, Ne, Ar, Kr, Xe, Rn) başqa bütün sadə maddələrlə birbaşa (normal şəraitdə, qızdırıldıqda və / və ya katalizatorların iştirakı ilə) reaksiya verir; halogenlər ilə reaksiyalar elektrik boşalması və ya ultrabənövşəyi radiasiyanın təsiri altında baş verir. Dolayı yolla qızıl və ağır inert qazların oksidləri (Xe, Rn)əldə edilir. Digər elementlərlə birlikdə bütün iki elementli oksigen birləşmələrində oksigen, flüor olan birləşmələr istisna olmaqla, oksidləşdirici maddə rolunu oynayır.
Oksigen oksigen atomunun formal olaraq −1-ə bərabər olan bir oksidləşmə vəziyyəti ilə peroksid əmələ gətirir.
- Məsələn, peroksidlər qələvi metalların oksigendə yanması ilə əldə edilir:
- Bəzi oksidlər oksigeni udur:
- A.N.Bax və K.O. Enqler tərəfindən hazırlanmış yanma nəzəriyyəsinə görə, oksidləşmə aralıq peroksid birləşməsinin meydana gəlməsi ilə iki mərhələdə baş verir. Bu aralıq birləşmə, məsələn, su ilə birlikdə hidrogen alovu alovunu soyudaraq su ilə birlikdə hidrogen peroksid meydana gələ bilər:
- Superperoksidlərdə oksigen rəsmi olaraq bir oksidləşmə vəziyyətinə yəni iki oksigen atomuna bir elektrona malikdir(ion O−2). Peroksidlərin oksigen ilə təzyiq və temperaturda qarşılıqlı təsiri nəticəsində əldə edilir:
Kalium K, rubidium Rb və sezium Cs oksigenlə reaksiya verərək superperoksid əmələ gətirirlər:
- Qeyri-üzvi ozonidlərin tərkibində oksigenin 1/3-ə bərabər dərəcədə oksigen oksidləşmə dərəcəsi olan bir O−3 ionu var. Qələvi metallar hidroksidlərindəki ozonun təsiri ilə əldə edilir:
- Dioksigenil ionu O2+ oksigen + ½ rəsmi bir oksidləşmə vəziyyətinə malikdir. Reaksiyada alınır:
Bu reaksiyada,oksigen eksponatlar bərpaedici xüsusiyyətlərə malikdir.
Oksigen floridləri
[redaktə | vikimətni redaktə et]- Oksigen difluorid, oksigenin OF2 oksidləşmə vəziyyəti +2, flüoru seyrəltilmiş qələvi həll yolu ilə əldə edilir:
- Oksigen monofloridi (Dioksid), O2F2, qeyri-sabit, oksigen oksidləşmə vəziyyəti +1, flüorun oksigen ilə qarışığından 6196 ° C temperaturda bir parıltı axıdılması nəticəsində əldə edilir:
- Müəyyən bir təzyiq və temperaturda flüorun oksigen ilə qarışığından parıltı axıdılması ilə daha yüksək oksigen floridlərinin O3F2]], O4F2, O5F2 və O6F2 qarışıqları alınır.
- Kvant mexaniki hesablamalar trifluorohidroxonium ionu OF3+-ün sabit olmasını proqnozlaşdırır[21].
Oksigen tənəffüs, yanma, çürümə proseslərini dəstəkləyir.
Sərbəst formada element iki allotropik dəyişiklikdə mövcuddur: O2 və O3 (ozon). 1899-cu ildə qurulan Pyer Küri və Mariya Küri ionlaşdırıcı şüalanmanın təsiri ilə O2 O3-ə daxil olur. Bu ion həqiqətən varsa, onda oksigen oksidləşmə dərəcəsi +4-ə bərabər olacaqdır[22][23].
Tətbiqi
[redaktə | vikimətni redaktə et]Metallurgiyada
[redaktə | vikimətni redaktə et]Polad istehsalının konvertor üsulu və ya mat emal oksigen istifadəsi ilə əlaqədardır. Bir çox metallurgiya bölməsində yanacağın daha səmərəli yanması üçün ocaqlarda hava yerinə oksigen-hava qarışığı istifadə olunur.
Metalların qaynağı və kəsilməsi
[redaktə | vikimətni redaktə et]Mavi rəngli silindrlərdəki oksigen alov kəsmə və metalların qaynaqlanması üçün geniş istifadə olunur.
Pervanel komponenti
[redaktə | vikimətni redaktə et]Maye oksigen, hidrogen peroksid, azot turşusu və digər oksigen zəngin birləşmələr raket yanacağında oksidləşdirici vasitə kimi istifadə olunur. Maye oksigen və maye ozon qarışığı raket yanacağının ən güclü oksidləşdiricilərindən biridir (hidrogen-ozon qarışığının xüsusi impulsu bir cüt hidrogen-florin və hidrogen-oksigen flüoridi üçün xüsusi impulsu üstələyir).
Tibbdə
[redaktə | vikimətni redaktə et]Tibbi oksigen, 15Pa (150 atm) qədər təzyiq altında 1,2 ilə 10,0 litrə qədər müxtəlif tutumlu mavi metal yüksək təzyiqli qaz silindrlərində saxlanılır və tənəffüs çatışmazlığı vəziyyətində, bronxial hücumu dayandırmaq üçün anesteziya cihazlarında tənəffüs qaz qarışıqlarını zənginləşdirmək, astma, dekompressiya xəstəliyi olan hər hansı bir genezisin hipoksiyasını aradan qaldırmaq, mədə-bağırsaq traktının patologiyasını oksigen kokteyli şəklində müalicə etmək üçün üçün istifadə olunur. Böyük tibb müəssisələri silindrlərdə sıxılmış oksigen istifadə edə bilməz, lakin böyük tutumlu Dyurar gəmisində mayeləşdirilir. Fərdi istifadə üçün xüsusi rezinləşdirilmiş qablar — oksigen yastıqları — silindrlərdən tibbi oksigen ilə doldurulur.Müxtəlif model və modifikasiyalı oksigen inhalerləri, eyni zamanda tarla və ya xəstəxanada yaralanan bir və ya iki nəfərə oksigen və ya oksigen-hava qarışığı vermək üçün istifadə olunur. Müxtəlif model və modifikasiyalı oksigen inhalerlərindən, eyni zamanda tarla və ya xəstəxanada yaralanan bir və ya iki nəfərə oksigen və ya oksigen-hava qarışığı vermək üçün istifadə olunur. Bir oksigen inhalerinin üstünlüyü, ekshalasiya edilmiş havanın nəmindən istifadə edərək qaz qarışığının kondensator-nəmləndiricisinin olmasıdır. Silindrdə qalan oksigenin miqdarını litrdə hesablamaq üçün ümumiyyətlə atmosferdəki silindrdəki təzyiq (ötürücü qutunun təzyiq ölçüləri ilə) silindr tutumunun litrdəki dəyərinə vurulur. Məsələn, 2 litr tutumlu bir silindrdə, manometr 100 atm bir oksigen təzyiqini göstərir. Bu vəziyyətdə oksigenin həcmi 100 × 2 = 200 litrdir[24].
Yeyinti sənayesində
[redaktə | vikimətni redaktə et]Qida sənayesində oksigen bir qida əlavəsi olaraq E948[25] qeyd olunur ,propellant və qablaşdırma qazı kimi də istifadə olunur.
Kimya sənayesində
[redaktə | vikimətni redaktə et]Kimya sənayesində oksigen çoxsaylı sintezlərdə reaktiv oksidləşdirici maddə kimi, məsələn, karbohidrogenlərin oksigen tərkibli birləşmələrə (spirtlər, aldehidlər, turşular) oksidləşməsi, kükürd dioksidin kükürd trioksidinə, ammonyak azot turşusu istehsalında azot oksidlərinə çevrilməsində istifadə olunur. Yüksək temperatur səbəbiylə,oksidləşmə zamanı inkişaf, sonuncu tez-tez yanma rejimində aparılır.
Kənd təsərrüfatında
[redaktə | vikimətni redaktə et]İstixanalarda, oksigen kokteyli istehsalı üçün, heyvanlarda kilo almaq üçün, balıq təsərrüfatında sulu mühitin oksigenlə zənginləşdirilməsi üçün istifadə olunur.
Oksigenin bioloji rolu
[redaktə | vikimətni redaktə et]
Çox canlılar (aeroblar) oksigenlə nəfəs alırlar. Oksigen tibbdə geniş istifadə olunur. Ürək-damar xəstəlikləri halında, metabolik prosesləri yaxşılaşdırmaq üçün mədəyə oksigen köpüyü ("oksigen kokteyli") daxil edilir. Subkutan oksigen trofik xoralar üçün istifadə olunur,fil xəstəliyi, qanqren və digər ciddi xəstəliklərdə istiadə olunur. Ozonla süni zənginləşdirmə, havanı dezinfeksiya etmək və dezodorasiya etmək və içməli suyu təmizləmək üçün istifadə olunur. Oksigen 15O radioaktiv izotopu qan axınının sürətini, ağciyər ventilyasiyasını öyrənmək üçün istifadə olunur.
Zəhərli oksigen törəmələri
[redaktə | vikimətni redaktə et]Singlet oksigen, hidrogen peroksid, superoksid, ozon və bir hidroksil radikal kimi bəzi oksigen törəmələri (sözdə reaktiv oksigen növləri) olduqca zəhərli məhsullardır. Onlar oksigenin aktivləşdirilməsi və ya qismən azaldılması prosesində əmələ gəlir. Superoksid (superoksid radikal), hidrogen peroksid və bir hidroksil radikal insan və heyvan orqanizminin hüceyrələrində və toxumalarında meydana gələ bilər və oksidləşdirici stressə səbəb ola bilər.
Oksigenin toksikliyi
[redaktə | vikimətni redaktə et]Saf oksigenin uzun müddət inhalyasiyası bədənə zərərli təsir göstərə bilər. 60% -ə qədər oksigen olan qarışıqlarla normal təzyiq altında uzun müddət nəfəs almaq təhlükəsizdir. 3 gün ərzində 90% oksigenlə nəfəs almaq taxikardiya, qusma, pnevmoniya və konvulsiyalara səbəb olur. Artan təzyiqlə oksigenin toksik təsiri sürətlənir və güclənir. Gənclər yaşlı insanlara nisbətən oksigenin toksik təsirlərinə daha həssasdırlar[26].
İzotoplar
[redaktə | vikimətni redaktə et]Oksigenin üç sabit izotopu var: 16O, 17O и 18O, bunların orta tərkibi yer üzündəki oksigen atomlarının ümumi sayının müvafiq olaraq 99,759%, 0,037% və 0,204% -dir. Qarışıqdakı ən az 16O izotopunun kəskin üstünlük təşkil etməsi, 16O atomunun nüvəsinin 8 proton və 8 neytrondan (doldurulmuş neytron və proton qabığı olan cüt sehrli nüvədən) ibarət olmasıdır.
Atom nüvəsinin quruluş nəzəriyyəsindən irəli gələn bu cür nüvələr xüsusilə sabitdir.
İstinadlar
[redaktə | vikimətni redaktə et]- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu.
- ↑ Дикислород Arxivləşdirilib 2016-03-04 at the Wayback Machine // Большая Энциклопедия Нефти Газа
- ↑ https://www.azleks.az/online-dictionary/m%C3%BCv%C9%99llid%C3%BClh%C3%BCmuz%C9%99?s=18 Arxivləşdirilib 2022-03-28 at the Wayback Machine müvəllidülhümuzə. oksigen
- ↑ https://viewer.rusneb.ru/ru/000200_000018_RU_NLR_ONL2_15989?page=64&rotate=0&theme=white Lüğət Rusi və Türki, Sultan-Məcid Qənizadə, 1909
- ↑ J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- ↑ W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ 1 2 Кнунянц И. Л. и др. Химическая энциклопедия. 2 (100000 nüs.). Москва: Советская энциклопедия. 1990. 387–389.
- ↑ Я. А. Угай. Общая и неорганическая химия. Москва: Высшая школа. 1997. 432–435.
- ↑ Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. Atmospheric oxygenation three billion years ago. (ingilis) (501). Nature. 2013. P. 535–538. doi:10.1038/nature12426. PMID 24067713.
- ↑ Campbell, Neil A.; Reece, Jane B. Biology, 7th Edition. San Francisco: Pearson – Benjamin Cummings. 2005. 522–23. ISBN 0-8053-7171-0.
- ↑ Freeman, Scott. Biological Science, 2nd. Upper Saddle River, NJ: Pearson – Prentice Hall. 2005. 214, 586. ISBN Biological Science, 2nd.
- ↑ Berner, Robert A. Atmospheric oxygen over Phanerozoic time // 49 (ingilis). Proceedings of the National Academy of Sciences of the USA. 1999. doi:10.1073/pnas.96.20.10955. PMID 0500106.
- ↑ Butterfield, N. J. Oxygen, animals and oceanic ventilation: An alternative view // 49 (ingilis) (7). Geobiology. 2009. P. 1–7. doi:10.1111/j.1472-4669.2009.00188.x. PMID 19200141.
- ↑ ""Лёгкие планеты" находятся в океане". 2015-12-08 tarixində arxivləşdirilib. İstifadə tarixi: 2020-01-13.
- ↑ Dole, Malcolm. The Journal of General Physiology (PDF) // 49 (ingilis). 1965. doi:10.1085/jgp.49.1.5. PMID 5859927.
- ↑ "ТАСС: Наука — Учёные: кислород в атмосфере Земли появился на 800 млн лет раньше, чем считалось ранее". 2016-04-23 tarixində arxivləşdirilib. İstifadə tarixi: 2020-01-13.
- ↑ 1 2 3 "Inorganic Crystal Structure Database". 2012-03-03 tarixində arxivləşdirilib. İstifadə tarixi: 2020-01-13.
- ↑ Yu. A. Freiman, H. J. Jodl. Solid oxygen. (ingilis). Physics Reports. 2004. P. 1—228. doi:10.1016/j.physrep.2004.06.002.
- ↑ Hiroshi Fujihisa, Yuichi Akahama, Haruki Kawamura, Yasuo Ohishi, Osamu Shimomura, Hiroshi Yamawaki, Mami Sakashita, Yoshito Gotoh, Satoshi Takeya, and Kazumasa Honda. O8 Cluster Structure of the Epsilon Phase of Solid Oxygen. (ingilis). Phys. Rev. Lett. 2006. P. 085503. doi:10.1103/PhysRevLett.97.085503.
- ↑ Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers, Paul Loubeyre. O8 molecular lattice in the ε phase of solid oxygen. (ingilis). Nature. 2006. P. 201—204. doi:10.1038/nature05174.
- ↑ Margaret-Jane Crawford и Thomas M. Klapötke. The trifluorooxonium cation, OF3+. (ingilis) (2). Journal of Fluorine Chemistry. 1999. P. 151–156. doi:10.1016/S0022-1139(99)00139-6.
- ↑ Curie P., Curie M. Effets chimiques produits par les rayons de Becquerel. (fransız) (2). Comptes rendus de l'Académie des Sciences[ing.]. 1899. 823—825. doi:10.1016/S0022-1139(99)00139-6.
- ↑ Радиационная химия. М.: Энциклопедический словарь. 1990. 200. ISBN 5-7155-0292-6.
- ↑ Руководство для врачей скорой помощи (2-е изд., перераб. и доп 120000 nüs.). Л.: Медицина. Михайлович В. А. 1990. 28–33. ISBN 5-225-01503-4.
- ↑ Food-Info.net: E-numbers: E948 : Oxygen Arxivləşdirilib 2009-04-04 at the Wayback Machine.
- ↑ Вредные химические вещества: Неорганические соединения элементов V–VIII групп. Справочник. — Л., 1989. — С. 150–170
Xarici keçidlər
[redaktə | vikimətni redaktə et]- Webelementsdə oksigen (ing.)
- Kimyəvi elementlərin populyar kitabxanasında oksigen (rus.)
- Ultra yüksək təzyiqlərdə bərk oksigen: molekulların əmələ gəlməsi O4 Arxivləşdirilib 2020-01-14 at the Wayback Machine (rus.)
- Narıncı oksigenin maqnit sifarişinə aydınlıq gətirilir (rus.)
- Qatı oksigen maqnit çökməsi (rus.)
- Suda oksigenin həlli TWT department of MPEI: Live Calculations by MAS (ing.)
- Alimlər karbon qazından birbaşa oksigen molekullarını əldə edə bildilər Arxivləşdirilib 2015-02-03 at the Wayback Machine (rus.)
- Kimyanı bil
- TANINAN VƏ TANINMAYAN OKSIGEN[ölü keçid]
- OKSİGEN. HAVA. YANMA























