Tantal(V) fluoride
| Tantan(V) fluoride | |
|---|---|
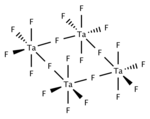 Cấu trúc của tantan(V) fluoride | |
| Tên khác | Tantan pentafluoride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Số RTECS | WW5775000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Công thức phân tử | TaF5 |
| Khối lượng mol | 275,939 g/mol |
| Bề ngoài | bột trắng |
| Khối lượng riêng | 4,74 g/cm³, rắn |
| Điểm nóng chảy | 96,8 °C (369,9 K; 206,2 °F) |
| Điểm sôi | 229,5 °C (502,6 K; 445,1 °F) |
| Độ hòa tan trong nước | thủy phân |
| MagSus | +795·10−6 cm³/mol |
| Cấu trúc | |
| Mômen lưỡng cực | 0 D |
| Các nguy hiểm | |
| Phân loại của EU | không được liệt kê |
| Nguy hiểm chính | chế phẩm từ HF |
| Chỉ dẫn R | 34 |
| Chỉ dẫn S | 26-27-28-36/37/39-45 |
| Điểm bắt lửa | không bắt lửa |
| Các hợp chất liên quan | |
| Anion khác | Vanadi(V) fluoride Niobi(V) fluoride |
| Cation khác | Tantan(V) chloride Tantan(V) bromide Tantan(V) iodide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Tantan(V) fluoride là một hợp chất vô cơ có công thức hóa học TaF5. Nó là một trong những hợp chất chính của tantan. Nó mang tính chất đặc trưng của một số pentafluoride, dễ bay hơi nhưng tồn tại dưới dạng oligomer ở trạng thái rắn.
Chuẩn bị và cấu trúc
[sửa | sửa mã nguồn]Nó được điều chế bằng cách xử lý kim loại tantan với khí fluor.[1] NbF5 được điều chế tương tự.
TaF5 rắn và nóng chảy đều là tetramer, bao gồm bốn tâm TaF6 được liên kết thông qua các tâm fluoride bắc cầu. Khí TaF5 có cấu trúc hình chóp tam giác với nhóm đối xứng D3h.[2]
Phản ứng và dẫn xuất
[sửa | sửa mã nguồn]Xu hướng của TaF5 là tạo thành các chất ở trạng thái rắn cho thấy tính acid Lewis của monome. Thật vậy, TaF5 phản ứng với các hợp chất chứa ion fluoride để tạo ra các ion TaF6−, TaF72− và TaF83−. Với các base Lewis trung tính, chẳng hạn như đietyl ete, TaF5 tạo thành các phức chất.
TaF5 được sử dụng kết hợp với HF làm chất xúc tác cho quá trình alkyl hóa ankan, anken và proton hóa các hợp chất thơm. Hệ TaF5–HF ổn định trong môi trường khử, không giống như hệ SbF5–HF. Khi có ion fluoride, tantan(V) fluoride tạo thành anion TaF83−, TaF72− hoặc TaF6−, tùy thuộc vào bản chất của phản ứng và nồng độ của HF. Nồng độ cao của HF có lợi cho hexafluoride do sự hình thành HF2−:
- TaF72− + HF ⇌ TaF6− + HF2−
Các muối M3TaF8 đã được kết tinh. Đối với K+=M+, các tinh thể bao gồm anion TaF72− cùng với một fluoride không phối hợp đến Ta(V).[3] Đối với M+=M+, các tinh thể có TaF83−.[4]
Liên quan đến việc tách Ta và Nb
[sửa | sửa mã nguồn]Trong quy trình Marignac, Nb và Ta được tách ra bằng cách kết tinh phân đoạn K2TaF7 từ dung dịch acid fluorhydric. Trong những điều kiện này, niobi tạo thành K2NbOF5, dễ hòa tan hơn K2TaF7. Khử K2TaF7 bằng natri sẽ cho Ta kim loại.[5]
Hợp chất khác
[sửa | sửa mã nguồn]TaF5 còn tạo một số hợp chất với NH3, như TaF5·3NH3 là tinh thể không màu.[6]
Tham khảo
[sửa | sửa mã nguồn]- ^ Priest, H. F. (1950). “Anhydrous Metal Fluorides. Inorganic Syntheses”. 3: 171-183. doi:10.1002/9780470132340.ch47. Chú thích journal cần
|journal=(trợ giúp) - ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Ľubomír Smrčok, Radovan Černý, Miroslav Boča, Iveta Macková, Blanka Kubíková (2010). “K3TaF8 from Laboratory X-ray powder data”. Acta Crystallographica C. 66 (2): pi16–pi18. doi:10.1107/S0108270109055140. PMID 20124670.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Langer, V.; Smrčok, L.; Boča, M. (2010). “Redetermination of Na3TaF8”. Acta Crystallographica C. 66 (9): pi85–pi86. doi:10.1107/S0108270110030556. PMID 20814090.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Klaus Andersson, Karlheinz Reichert, Rüdiger Wolf "Tantalum and Tantalum Compounds" in Ullmann's Encychlorpedia of Industrial Chemistry 2002, Wiley-VCH. Weinheim. doi:10.1002/14356007.a26_071
- ^ Sebastian A. Baer, Matic Lozinšek, Fluorian Kraus – Synthesis and Crystal Structure of Triammine Pentafluorido Tantalum(V) [TaF5(NH3)3]. ZAAC 639 (14): 2586–2588 (ngày 30 tháng 8 năm 2013). doi:10.1002/zaac.201300342.

